装置示意图 | 序号 | 电解质溶液 | 实验现象 |
| ① | 阴极表面有无色气体,一段时间后阴极表面有红色固体,气体减少。经检验电解液中有 | |
② | 阴极表面未观察到气体,一段时间后阴极表面有致密红色固体。经检验电解液中无 |
下列说法错误的是( )


中和时pH的理论范围为;酸化的目的是;Fe元素在(填操作单元的名称)过程中除去。

方法I:氨热分解法制氢气
相关化学键的键能数据
|
化学键 |
| | |
| 键能 | 946 | 436.0 | 390.8 |
一定温度下,利用催化剂将 分解为
和
。回答下列问题:
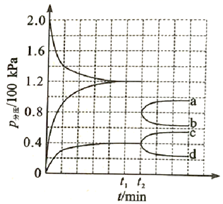
①若保持容器体积不变, 时反应达到平衡,用
的浓度变化表示
时间内的反应速率
(用含
的代数式表示)
② 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后
分压变化趋势的曲线是(用图中a、b、c、d表示),理由是;
③在该温度下,反应的标准平衡常数 。(已知:分压=总压×该组分物质的量分数,对于反应
,
,其中
,
、
、
、
为各组分的平衡分压)。
方法Ⅱ:氨电解法制氢气
利用电解原理,将氮转化为高纯氢气,其装置如图所示。

KOH溶液KOH溶液


①电池负极电极反应式为;放电过程中需补充的物质A为(填化学式)。
②图-2所示的 HCOOH燃料电池放电的本质是通过 HCOOH与O2的反应,将化学能转化为电能,其反应的离子方程式为。

①HCOOD催化释氢反应除生成CO2外,还生成(填化学式)。
②研究发现:其他条件不变时,以 HCOOK溶液代替 HCOOH催化释氢的效果更佳,其具体优点是。
|
物质 |
C2H6(g) |
C2H4(g) |
H2(g) |
|
燃烧热ΔH/( kJ·mol−1) |
-1560 |
-1411 |
-286 |
①ΔH=kJ·mol−1。
②提高该反应平衡转化率的方法有、。
③容器中通入等物质的量的乙烷和氢气,在等压下(p)发生上述反应,乙烷的平衡转化率为α。反应的平衡常数Kp=(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
①设反应开始时的反应速率为r1 , 甲烷的转化率为α时的反应速率为r2 , 则r2= r1。
②对于处于初期阶段的该反应,下列说法正确的是。
A.增加甲烷浓度,r增大 B.增加H2浓度,r增大
C.乙烷的生成速率逐渐增大 D.降低反应温度,k减小

①阴极上的反应式为。
②若生成的乙烯和乙烷的体积比为2∶1,则消耗的CH4和CO2体积比为。