| 粒子组 | 判断和分析 | |
| A | | 不能大量共存,因发生反应: |
| B | | 不能大量共存,因发生反应: |
| C | | 能大量共存,粒子间不反应 |
| D | | 能大量共存,粒子间不反应 |
步骤I. 的制备
 步骤Ⅱ.产品中
步骤Ⅱ.产品中 含量测定
①称取产品2.500g,用蒸馏水溶解,定容于250mL容量瓶中;
②移取25.00mL上述溶液于锥形瓶,加入2滴指示剂M,用 盐酸标准溶液滴定,溶液由红色变至近无色(第一滴定终点),消耗盐酸
;
③在上述锥形瓶中再加入2滴指示剂N,继续用 盐酸标准溶液滴定至终点(第二滴定终点),又消耗盐酸
;
④平行测定三次, 平均值为22.45,
平均值为23.51。
已知:(i)当温度超过35℃时, 开始分解。
(ii)相关盐在不同温度下的溶解度表
| 温度/ | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
| | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| | 11.9 | 15.8 | 21.0 | 27.0 | |||
| | 6.9 | 8.2 | 9.6 | 11.1 | 12.7 | 14.5 | 16.4 |
| | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | 55.2 |
回答下列问题:
 C .
C .  D .
D . 方法I:氨热分解法制氢气
相关化学键的键能数据
|
化学键 |
| | |
| 键能 | 946 | 436.0 | 390.8 |
一定温度下,利用催化剂将 分解为
和
。回答下列问题:
①若保持容器体积不变, 时反应达到平衡,用
的浓度变化表示
时间内的反应速率
(用含
的代数式表示)
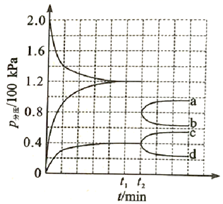
② 时将容器体积迅速缩小至原来的一半并保持不变,图中能正确表示压缩后
分压变化趋势的曲线是(用图中a、b、c、d表示),理由是;
③在该温度下,反应的标准平衡常数 。(已知:分压=总压×该组分物质的量分数,对于反应
,
,其中
,
、
、
、
为各组分的平衡分压)。
方法Ⅱ:氨电解法制氢气
利用电解原理,将氮转化为高纯氢气,其装置如图所示。

KOH溶液KOH溶液
硅、锗(Ge)及其化合物广泛应用于光电材料领域。回答下列问题:
| | | | | |
| 熔点/K | 183.0 | 203.2 | 278.6 | 393.7 |
| 沸点/K | 187.2 | 330.8 | 427.2 | 560.7 |
①0℃时, 、
、
、
呈液态的是(填化学式),沸点依次升高的原因是,气态
分子的空间构型是;
② 与N-甲基咪唑
![]() 反应可以得到
反应可以得到 ,其结构如图所示:

N-甲基咪唑分子中碳原子的杂化轨道类型为,H、C、N的电负性由大到小的顺序为,1个 中含有个
键;

①已知化合物中 和
的原子个数比为1:4,图中Z表示原子(填元素符号),该化合物的化学式为;
②已知该晶胞的晶胞参数分别为anm、bnm、cnm, ,则该晶体的密度
(设阿伏加德罗常数的值为
,用含a、b、c、
的代数式表示)。
①苯环上有2个取代基②能够发生银镜反应③与 溶液发生显色发应
其中核磁共振氢谱有五组峰,且峰面积之比为6:2:2:1:1的结构简式为;
 为原料,设计合成
为原料,设计合成  的路线(其他试剂任选)。
的路线(其他试剂任选)。