 除去CO中的CO2
B .
除去CO中的CO2
B .  检查装置的气密性
C .
检查装置的气密性
C .  稀释浓硫酸
D .
稀释浓硫酸
D .  制取氧气
制取氧气
选项 | 物质 | 除杂方案 |
A | CO2(HCl) | 通过盛有 NaOH溶液的洗气瓶 |
B | KClO3固体(KCl) | 加热至不再产生气体 |
C | KNO3溶液(KOH) | 加入适量CuSO4溶液,过滤、蒸发 |
D | MgCl2溶液(NaCl) | 加入过量KOH溶液,过滤、洗涤,向所得固体中加入适量稀盐酸至固体恰好溶解 |

|
|
|
|
A.在一定量的CaCl2溶液中通入CO2气体 | B.将浓硫酸露置在空气中 | C.足量粉末状金属分别与等质量、等浓度的稀盐酸反应 | D.一定质量的饱和石灰水中加入生石灰 |
①电木插座破裂后能热修补
②不用其他试剂就能将NaCl、FeCl3、KOH、(NH4)2SO4、H2SO4五种溶液一一区分
③探究Zn、Fe、Ag的金属活动性,可将Fe和Ag分别放入ZnSO4溶液中
④Na2CO3溶液和Ba(OH)2溶液充分反应后,得到白色沉淀A和溶液B,向溶液B中加入少量稀盐酸,无明显现象。则溶液B中不含Na2CO3
⑤有MgSO4和H2SO4的混合溶液100g,先向其中滴加BaCl2溶液,再滴加NaOH溶液,产生沉淀质量与加入溶液质量关系如图所示。则原混合溶液中镁、硫元素的质量比为3:10


a.蛋白质 b.糖类 c.油脂 d.无机盐
李明在水稻生长过程中发现部分水稻有叶片发黄和倒伏现象,他需要及时施加的一种肥料是(填序号)。
a.KCl b.NH4NO3 c.KNO3 d.NH4H2PO4
①C+O2CO2②CaO+H2O=Ca(OH)2③CaCO3
CaO+CO2↑
④2H2O22H2O+O2↑ ⑤CO+CuO
Cu+CO2⑥HCl+NaOH=NaCl+H2O
通过进一步定量分析上述氧化还原反应的化合价变化发现:氧化还原反应中元素化合价升高总数(填“大于”、“等于”或“小于”)元素化合价降低总数。根据氧化还原反应的概念,置换反应一定属于氧化还原反应,那么复分解反应(填“一定属于”、“一定不属于”或“可能属于”)氧化还原反应。
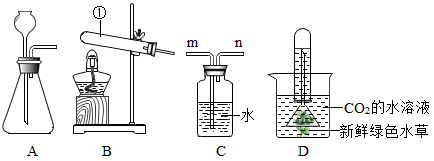


早在春秋战国时期,我国就开始生产和使用铁器。工业上炼铁的原理是利用一氧化碳和氧化铁的反应。某化学兴趣小组利用下图装置进行实验探究,请按要求填空:

写出炼铁的反应方程式。
用工业烧渣(含有Fe2O3、FeO和SiO2)制备化工原料铁红的实验流程如图1:

酸溶前将烧渣粉碎,目的是。
铁触媒是工业合成氨的催化剂(主要成分为Fe3O4)。用下列装置对铁触媒的制备进行研究。取 48.00g铁红置于装置A中,控制不同的温度对其加热,测得装置B和C的质量变化如表。

表:装置B和C的质量变化
温度/℃ | 装置B/g | 装置C/g |
室温 | 300.00 | 400.00 |
500 | 300.45 | 400.55 |
600 | 300.90 | 401.10 |
650 | 301.80 | 402.20 |
资料:①实验室中浓硫酸用于吸收水分,碱石灰用于吸收二氧化碳和水分。
②加热到500℃以上,Fe2O3和CH4开始反应,生成铁的其他氧化物、CO2和H2O。温度高于700℃,生成Fe。
加热前后及过程中均需通入CH4 , 加热前通CH4的目的是。
【查阅资料】①Na2CO3+H2O+CO2=2NaHCO3
②20℃时NaOH、Na2CO3、NaHCO3在水中的溶解度:
物质 | NaOH | Na2CO3 | NaHCO3 |
溶解度 | 109g | 21.5g | 9.6g |
③通常情况下,CaCl2溶液与NaHCO3的稀溶液混合无明显现象;
④碳酸氢钠受热易分解:
【作出猜想】猜想一:Na2CO3;猜想二:;猜想三:Na2CO3和NaHCO3
实验操作 | 实验现象 | 实验结论 | |
实验一 | 取少量白色固体于试管中,加足量水溶解,再加入过量CaCl2溶液 | 产生白色沉淀 | 猜想①不成立。 |
实验二 | 取实验一中的上层清液滴加适量稀盐酸 | ②。 | 猜想三成立 |
写出实验二中发生反应的化学方程式。

①装置B中盛装的药品是。
②装置D的作用是。
