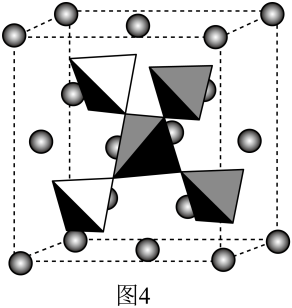
|
|
|
|
|
| A.新石器时代·红陶兽形器 | B.北燕·鸭形玻璃柱 | C.明·象牙雕佛坐像 | D.清·五彩花卉瓷盖碗 |
|
|
|
|
|
| A.制备CO2 | B.制备NaHCO3 | C.加热NaHCO3固体 | D.检测产品中是否含有NaHCO3 |

| 选项 | 实验操作 | 结论 |
| A | 加热醋酸水溶液(忽略溶质的挥发) | 溶液的导电能力、HAc的电离程度均增大 |
| B | 常温下测得NH4Ac水溶液 | NH4Ac溶于水不发生水解 |
| C | 加入NaOH溶液与醋酸溶液恰好中和 | 中和后: |
| D | 常温下,HAc溶液与NaOH溶液混合,测得溶液pH为4.76 | 反应后: |
| 选项 | 实验操作 | 目的 |
| A | 乙醇与浓硫酸混合迅速加热到 | 制备乙烯 |
| B | 分别测定饱和 | 比较 |
| C | 铁锈溶于稀盐酸,再滴加酸性高锰酸钾溶液 | 检验铁锈中是否含 |
| D |
| 比较 |
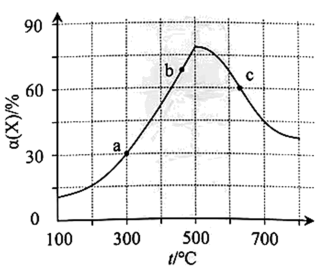

【提出猜想】
猜想a:Cu(NO3)2浓度大
猜想b:NO2溶解在Cu(NO3)2溶液中
【实验验证】
实验i:配制饱和Cu(NO3)2溶液,溶液呈色,证明猜想a不成立。
实验ii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入空气后,溶液上方可观察到,5min后,溶液完全变为蓝色,证明猜想b成立。

①由此该组同学认为通过实验说明猜想b成立不严谨,理由是。
②写出NO2与水反应生成HNO2的化学方程式。
③该组同学改进后设计了新的实验:
实验iii:取适量Cu与浓HNO3反应后的溶液,置于图2所示装置中,鼓入氮气后,溶液上方现象与实验ii相同,但5min后,溶液仍为绿色。对比实验ii与实验iii,可推测Cu(NO3)2溶液为绿色的原因主要是。
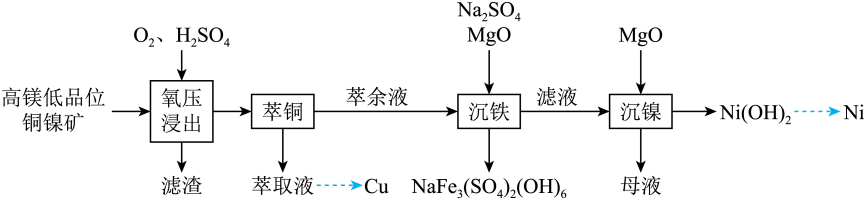
回答下列问题:
①苯环上有二个取代基;
②能发生银镜反应,不能发生水解反应;
③核磁共振氢谱显示有5种不同化学环境的氢原子,且峰面积之比为3∶2∶2∶1∶1。
 的路线(其它无机试剂任选)。
的路线(其它无机试剂任选)。
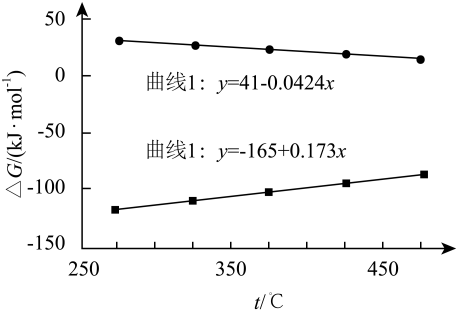

①在工业上,常选用作为合成温度,原因是。
②时
对甲烷的选择性=(保留2位有效数字,已知:选择性=生成
的物质的量/参与反应的
的物质的量),该温度下反应II的
。(保留2位有效数字,已知:分压=组分物质的量分数×总压)