




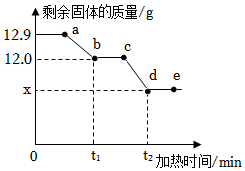
| 物质 | 甲 | 乙 | 丙 | 丁 | |
| 微观示意图 | | | | | |
| 反应前质量/g | 32 | 200 | 1 | 0 | |
| 反应后质量/g | 0 | x | y | z |
下列有关该反应的说法正确的是( )
 B . 制取气体
B . 制取气体  C . 收集
C . 收集  D . 验满
D . 验满 










气体检验→气体净化→气体转化→气体检验→得出结论。

实验过程中,各装置内发生现象如下表所示(C中氢氧化钠溶液足量)
| 装置 | 现 象 |
| 装置A | 亮绿色晶体变成白色和红棕色固体,玻璃管壁上有小水珠 |
| 装置B、F | 澄清石灰水均变浑浊 |
| 装置E | 固体变为红色 |
|
实验次数 |
1 |
2 |
3 |
4 |
5 |
|
加入Na2CO3溶液的质量/g |
50.0 |
50.0 |
50.0 |
50.0 |
50.0 |
|
反应后溶液的总质量/g |
345.0 |
390.0 |
M |
483.0 |
533.0 |

|
实验编号 |
实验药品 |
分解温度 |
|
1 |
3.0g氯酸钾 |
460℃ |
|
2 |
3.0g氯酸钾和0.5g二氧化锰 |
248℃ |
|
3 |
3.0g氯酸钾和0.5g氧化铜 |
267℃ |
|
4 |
3.0g氯酸钾和Xg氧化铁 |
290℃ |

①如甲图所示装置的气密性良好,三只250mL的烧瓶内收集满CO2气体,三个注射器内各装有90mL的水、饱和澄清石灰水、40%的氢氧化钠溶液。连接好装置和压强传感器。
②三位同学同时迅速将注射器内90mL的液体注入各自烧瓶中,关闭活塞。
③一段时间后,同时振荡烧瓶。观察传感器传回烧瓶内气压变化形成的图像情况如乙图所示。



|
实验顺序 |
第1瓶 |
第2瓶 |
第3瓶 |
第4瓶 |
第5瓶 |
第6瓶 |
|
氧气含量 |
60% |
40% |
30% |
50% |
35% |
32.5% |
|
带火星的木条 |
复燃 |
复燃 |
不复燃 |
复燃 |
复燃 |
不复燃 |
【交流评价】小明认为实验中有一瓶氧气无需收集进行实验,请指出是哪一瓶并说明理由。
【实验结论】继续实验,最终得出使带火星木条复燃的氧气含量的最小值约为33%。
小科猜想:Na2CO3和盐酸反应放热。
小开认为小科猜想有不足之处,为此设计实验进一步研究:
①取0.5gNa2CO3固体放入烧杯中,加入10mL水(20℃),搅拌,测量温度t1
②静置一段时间后,测量温度t2
③加入10mL 20%的盐酸(t0),搅拌,测量温度t3
多次实验后取平均值记录如下:
|
t1/℃ |
t2/℃ |
t3/℃ |
|
23.3 |
20.0 |
23.7 |




①准备如图乙所示的玻璃容器,顶部用密封盖密封,检查该装置的气密性。
②将氧气传感器(能实时显示容器内氧气的体积分数)固定在容器内壁,装入足量的红磷。
③用激光笔点燃红磷,红磷剧烈燃烧,观察并记录氧气传感器所显示的氧气体积分数,绘制氧气体积分数随时间变化的图像(如图丙)。
④将红磷分别用白磷、食品脱氧剂替换(只与空气中的氧气反应),重复上述步骤。
|
加入稀盐酸的次数 |
第一次 |
第二次 |
第三次 |
第四次 |
|
烧杯及反应后混合物的总质量/g |
101.4 |
124.8 |
148.6 |
173.6 |

请分析以上数据后计算:

【实验步骤】:
①把足量的白磷放入带刻度的小药瓶中,再把小药瓶放入热水中;(气密性良好)
②待白磷自燃冒出白烟后冷却至室温;
③把输液管的A端伸入装有硫酸铜溶液的烧杯中,打开阀门;
【实验现象】:
进入小药瓶的硫酸铜溶液约占小药瓶体积的1/5。
【交流评价】:

|
实验序号 |
1 |
2 |
3 |
|
碳酸氢钠片样品质量/克 |
6.0 |
6.0 |
6.0 |
|
反应前总质量/克 |
193.8 |
194.6 |
193.6 |
|
反应后总质量/克 |
191.6 |
192.6 |
191.2 |
|
二氧化碳质量/克 |
请计算出药片中碳酸氢钠的质量分数。

①实验前缓缓通入一段时间的空气,这段时间长度的标准是:__________。
②计算石灰石样品中碳酸钙的质量分数?
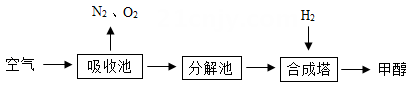
该技术流程的主要反应化学方程式如下:
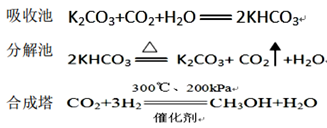
根据以上资料,回答下列问题
