
 )发生缩聚反应
)发生缩聚反应



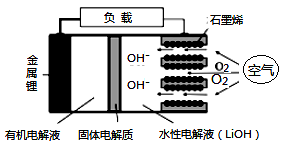

选项 | 实验内容 | 实验结论 |
A. | 取两只试管,分别加入4mL0.01mol/LKMnO4酸性溶液,然后向一只试管中加入0.01mol/L H2C2O4溶液2mL,向另一只试管中加入0.01mol/L H2C2O4溶液4mL,第一只试管中褪色时间长。 | H2C2O4浓度越大,反应速率越快 |
B. | 向电石中滴加饱和食盐水,将产生的气体通入酸性KMnO4溶液中,溶液褪色。 | 产生的气体为乙炔 |
C. | 取两只试管,分别加入等体积等浓度的双氧水,然后试管①中加入0.01mol/LFeCl3溶液2mL,向试管②中加入0.01mol/L CuCl2溶液2mL,试管①产生气泡快。 | 加入FeCl3时,双氧水分解反应的活化能较大。 |
D. | 检验FeCl3溶液中是否含有Fe2+时,将溶液滴入酸性KMnO4溶液,溶液紫红色褪去。 | 不能证明溶液中含有Fe2+ |
 , S原子的杂化方式为,S元素的化合价为。
, S原子的杂化方式为,S元素的化合价为。


已知:A的相对分子质量为62,在氧气中灼烧可得物质的量之比为2:1的两种气体;钠汞齐是单质钠溶于单质汞形成混合物,是一种强还原剂;B、E含有相同的阴离子。
请回答:

①已知相关反应的能量变化如图所示,过程Ⅰ的热化学方程式为。

②关于上述过程Ⅱ的说法错误的是(填序号)。
a.实现了含碳物质与含氢物质的分离 b.可表示为CO2+H2=H2O(g)+CO
c.CO未参与反应 d. Fe3O4、CaO为催化剂,降低了反应的△H
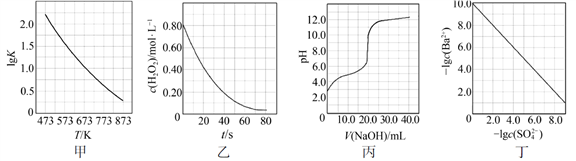
③其他条件不变,在不同催化剂Ⅰ、Ⅱ、Ⅲ作用下,反应CH4(g)+CO2(g)=2CO(g)+2H2(g)进行相同时间后,CH4的转化率随反应温度的变化如图所示。a点所代表的状态(填“是”或“不是”)平衡状态;b点CH4的转化率高于c点,原因是。


资料卡片:
物质 | 熔点/℃ | 沸点/℃ | 相对分子质量 | 其他 |
PCl3 | -93.6 | 76.1 | 137.5 | 遇水剧烈水解,易与O2反应 |
POCl3 | 1.25 | 105.8 | 153.5 | 遇水剧烈水解,能溶于PCl3 |
SOCl2 | -105 | 78.8 | 119 | 遇水剧烈水解,受热易分解 |
请回答:
①达到滴定终点的现象是。
②POCl3的质量分数为(保留三位有效数字)。
③已知:Ksp(AgCl)=3.2×10-10 , Ksp(AgSCN)=2×10-12 , 若无硝基苯覆盖沉淀表面,测定POCl3的质量分数将(填“偏大”“偏小”或“无影响”)。
 的合成路线。(用流程图表示,无机试剂任选)
的合成路线。(用流程图表示,无机试剂任选)
①IR谱表明分子中有苯环和一个含非碳原子的五元环
②分子中不存在N-O键、O-O键
③1H-NMR谱显示分子中有5种氢原子