
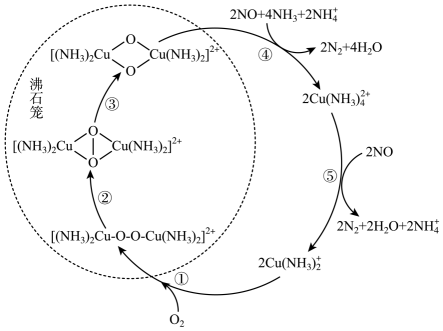
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 向盛有饱和 | 溶液变浑浊且有气泡逸出 | 生成了S和 |
B | 向饱和食盐水中通入氨气至饱和后,再通入过量二氧化碳 | 溶液变浑浊 | 析出了 |
C | 加热无水乙醇和浓 | 红色褪去 | 乙醇发生了消去反应生成了乙烯 |
D | 室温下,用pH计测定浓度均为0.1mol/L的NaClO溶液、 | NaClO溶液的pH较大 | 酸性: |
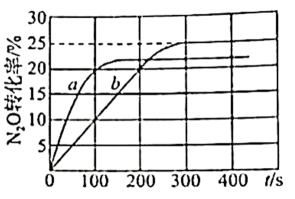
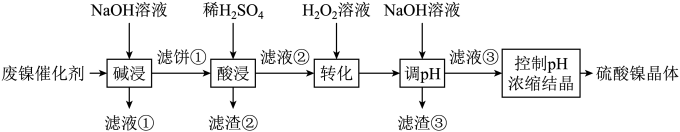
溶液中金属离子开始沉淀和完全沉淀的pH如表所示:
金属离子 | Ni2+ | Al3+ | Fe3+ | Fe2+ |
开始沉淀时(c=0.01mol·L−1)的pH | 7.2 | 3.7 | 2.2 | 7.5 |
沉淀完全时(c=1.0×10−5mol·L−1)的pH | 8.7 | 4.7 | 3.2 | 9.0 |
回答下列问题:
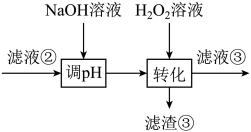

回答下列问题:

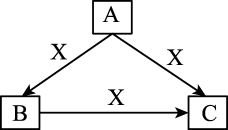
反应物分子有效碰撞几率最大的步骤对应的基元反应为。
①
②
反应的ΔH=
。
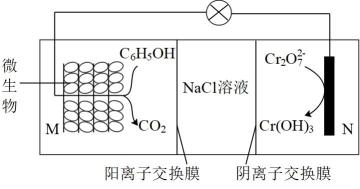
[]

①1molM与足量NaHCO3溶液反应最多产生标况下气体44.8L
②苯环上有三个取代基,2个氯原子直接连在苯环上相邻位置