

已知:①H2O、卤化氢等杂质易使Ni催化剂中毒;②催化剂乙基蒽醌难溶于水,易溶于有机溶剂,熔点107-111℃。下列说法中正确的是

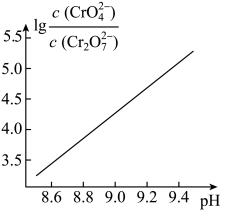

已知:①25℃时溶液中金属离子物质的量浓度c与溶液pH的关系如图所示:

②Sr (OH)2、 Ca (OH) 2在不同温度下的溶解度表
|
温度/℃ |
0 |
20 |
40 |
60 |
80 |
90 |
100 |
|
Ca(OH)2/g |
0.19 |
0.17 |
0.14 |
0.12 |
0.09 |
0.08 |
0.07 |
|
Sr(OH)2/g |
0.91 |
1.77 |
3.95 |
8.42 |
20.20 |
44.50 |
91.20 |
回答下列问题:

已知:①碱式碳酸铜的组成与溶液pH有关;
②碱式碳酸铜和碳酸氢钠在水溶液中比固态时更易分解。
实验室制备四水甲酸铜的步骤如下:
I.称取12.5 g CuSO4·5H2O和9.5 g NaHCO3 , 充分研细并混合均匀。
II.将I中所得混合物加入到100 mL接近沸腾的蒸馏水中,加完混合物后继续加热至接近沸腾状态数分钟。
III.静置溶液澄清后,用倾析法分离得到沉淀,用蒸馏水洗涤,干燥。
IV.将III中所得的产品放入如图装置中的三颈烧瓶,加入约20 mL蒸馏水,加热搅拌至50℃左右。

V.向三颈烧瓶中加入甲酸,反应结束后趁热过滤。
VI.经过一系列操作得到Cu (HCOO) 2·4H2O 7.91 g。
回答下列问题:
实际取用的硫酸铜和碳酸氢钠的物质的量之比小于1:2,这样操作的原因是。
反应I: CO2(g) +3H2(g)CH3OH(g) +H2O(g) ΔH1 = -49.6 kJ·mol-1
反应: II.CO2(g) +H2(g)CO(g) +H2O(g) ΔH2= + 41.2 kJ·mol-1
当原料组成为n(CO2):n(H2)=1:3时,上述反应体系在一定条件下建立平衡后,含碳产物中CH3OH的物质的量分数(Y)及CO2的转化率(Q )与反应温度的关系曲线如图所示。
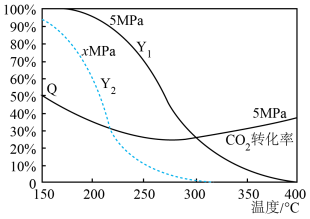
图中A,B,C,D点的纵坐标分别为a+2、a+1、a-1、a-2,则温度为T1时,反应II的化学平衡常数K=。


基态硒原子的价层电子轨道表示式为。

每个Cu2-xSe晶胞中含有个Cu2+(用含x的表达式作答)。
a.分子结构中含有苯环,不含有甲基
B.苯环上只有两个取代基
C.1molK分别能与3molNa、2molNaOH、1molNaHCO3反应