1.
(2023·兰州模拟)
我国科学家在淀粉人工光合成方面取得重大突破性进展,该实验方法首先将CO2催化还原为CH3OH。已知CO2催化加氢的主要反应有:
反应I: CO2(g) +3H2(g) CH3OH(g) +H2O(g) ΔH1 = -49.6 kJ·mol-1
CH3OH(g) +H2O(g) ΔH1 = -49.6 kJ·mol-1
反应: II.CO2(g) +H2(g) CO(g) +H2O(g) ΔH2= + 41.2 kJ·mol-1
CO(g) +H2O(g) ΔH2= + 41.2 kJ·mol-1
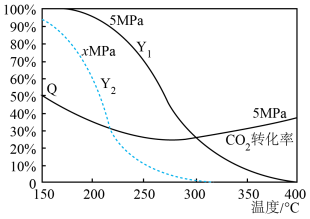
当原料组成为n(CO2):n(H2)=1:3时,上述反应体系在一定条件下建立平衡后,含碳产物中CH3OH的物质的量分数(Y)及CO2的转化率(Q )与反应温度的关系曲线如图所示。
-
(1)
反应CO(g) +2H
2(g)

CH
3OH (g)的焓变ΔH =
。
-
-
(2)
据如图判断x5(选填 “大于”“小于”或“等于”),理由是。
-
-
(3)
下列说法正确的有 。
A . 升高温度,CO2转化速率减慢
B . 恒温恒容条件下,体系密度不变表明反应达到平衡状态
C . 5MPa、温度高于300℃后,含碳产物以CO为主
D . 5MPa、300~ 400℃范围内, H2O的平衡产量随反应体系温度升高而增大
-
-
(4)
在一定温度下,向体积固定的密闭容器中加入1 mol CO2 (g)和3molH2 (g),起始压强为4MPa,发生反应I和II。平衡时,CO2(g) 的转化率为40%, CO (g)的物质的量为0.1 mol。反应I的分压平衡常数Kp=(气体分压 =总压 ×该组分的物质的量分数)。
-
-
(5)
反应II的正反应速率方程为v
正=k
正·c(CO
2)·c(H
2),逆反应速率方程为v
逆=k
逆·c (CO)·c(H
2O),其中k
正、k
逆分别为正、逆反应的速率常数,只受温度影响。lgk(速率常数的对数)与1/T (温度的倒数)的关系符合如图中的两条线,其中表示lg k
逆的是
,理由是
。
图中A,B,C,D点的纵坐标分别为a+2、a+1、a-1、a-2,则温度为T1时,反应II的化学平衡常数K=。

-
CH3OH(g) +H2O(g) ΔH1 = -49.6 kJ·mol-1
CO(g) +H2O(g) ΔH2= + 41.2 kJ·mol-1

