




序号 | 实验操作 | 实验现象 |
Ⅰ | 将1mLpH=1的0.1mol·L-1 FeSO4溶液和2滴0.1mol·L-1KSCN溶液混合,接着向混合溶液中逐滴滴加0.5mL0.3mol·L-1的H2O2溶液 | 滴入H2O2溶液,溶液立即变红,继续滴加,溶液红色变浅并逐渐褪去 |
Ⅱ | 向i的混合溶液中滴入KSCN溶液 | 溶液变红 |
Ⅲ | 向1mL0.3mol·L-1的H2O2溶液中滴加2滴0.1mol·L-1KSCN溶液,继续加入0.5mLpH=1的H2SO4溶液,静置2min | 无明显现象 |
Ⅳ | 向ⅲ的混合溶液中滴入2滴Fe2(SO4)3溶液 | 滴入Fe2(SO4)3溶液,溶液立即变红,静置2min,溶液红色变浅并逐渐褪去 |
下列说法错误的是

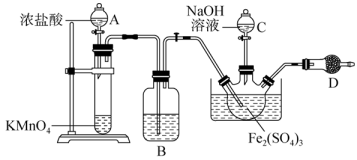
仪器D的名称为。洗气瓶B中盛有的试剂为。实验开始,先打开分液漏斗(填“A”或“C”)的活塞。
取一定量Na2FeO4加入试管中,向其中加入0.2mol•L-1的NaCN溶液10mL,CN-被氧化为CO和N2。充分反应后测得试管中仍有Na2FeO4剩余,过滤。向滤液中加入足量BaCl2溶液,生成白色沉淀,将沉淀过滤干燥后称量,得白色沉淀0.3546g。
①配制0.2mol•L-1的NaCN溶液,需要的玻璃仪器有(填序号,下同)。

②计算NaCN溶液中CN-的去除率为(保留两位有效数字)。

②CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H2=-75.6kJ•mol-1
则③CO(g)+2H2(g)CH3OH(g)△H=。

软锰矿主要成分 | 杂质 |
MnO2 | MgO、FeO、Fe2O3、Al2O3、SiO2等杂质 |
某科研团队设计制备高纯度MnCO3。反应原理为①MnO2+BaS+H2O=MnO+Ba(OH)2+S;②MnO+H2SO4=MnSO4+H2O;③硫酸锰+碳酸氢铵+一水合氨→MnCO3↓(白色)。工艺流程图如图。
回答下列问题:
