






已知:环己醇相对分子质量为100,熔点为24℃,沸点为161 ℃,密度为0.95 g/mL;己二酸相对分子质量为146,微溶于水,且温度越低溶解度越小。
实验步骤如下:
i.向三颈瓶中加入3. 5 g碳酸钠和50 mL温水,在搅拌下加入10 g高锰酸钾。
ii.待高锰酸钾溶解后,用滴管慢慢加入2.6 mL环己醇,维持反应温度在43〜47℃之间。
iii.环己醇滴加完毕,待反应完成,使二氧化锰沉淀凝结,然后加适量固体亚硫酸氢钠除去过量的高锰酸钾。
iv.趁热抽滤,滤渣用热水洗涤三次,合并滤液与洗涤液,用浓盐酸调pH至1〜2。
v.将滤液加热浓缩至20 mL左右,冷却,结晶,抽滤,洗涤,干燥,称重(得到产品1.5 g),计算产率。
请回答下列问题:
使用改进后的装置,考查了步骤ii中滴加速度分别为6、18、25 s •滴-1共3种情况下的反应状况、滤渣和滤液及产品性状。见下表所示。
滴加时间 /min | 滴加速度 /(s •滴-1) | 反应过程监控 | 滤渣 | 滤液 | 产品性状 |
20 | 6 | 7 min,T=100℃,发生冲料;20 min滴加完,反应完成 | 黑色,偏褐色,量大 | 澄清透明, 偏黄绿色 | 量少,乳白 色,稍黄 |
60 | 18 | Tmax =74℃环己醇滴加完T =44℃ ,60 min反应完成 | 黑色固体 | 无色,澄清, 透明 | 无色晶体 |
90 | 25 | 13min,温度没有变化;23min,T=40℃;Tmax=53℃;环己醇滴加完,T=41℃反应不完全,水浴加热20min,反应完成 | 黑色固体 | 无色,澄清, 透明 | 无色片状晶体,晶型很漂亮 |

已知:①滤渣I主要成分是难溶于水的Ce(BF4)3;
②常温下,Ka1(H2CO3) =4.3×10-7 , Ka2(H2CO3) =5.6×10-11 , Ksp[Ce2(CO3)3]=1.0×1.0-28;
③Ce3 +在空气中易被氧化为Ce4+。
回答下列问题:
|
物质 |
H2(g) |
CO2(g) |
CH3OH(g) |
H2O(g) |
|
|
0 |
- 393.5 |
- 201 |
- 241.8 |
①CO2(g)+3H2(g)CH3OH(g)+H2O(g) ΔH= kJ• mol-1。
②在一定条件下,向恒容密闭容器中充入1 mol CO2和3 mol H2 , 发生反应①,测得在相同时间内,不同条件下H2的转化率如图1所示(在实验条件下催化剂不会失活),b点前L1 高于L2 , b点后L1和L2重合,其原因可能是;T2时,若起始压强为15 atm,Kp=atm-2(结果保留两位有效数字,Kp为以分压表示的平衡常数,分压=总压×物质的量分数)。

③已知速率方程v正=k正c(CO2)·c3(H2),v逆=k逆c(CH3OH)• c (H2O),k正、k逆是速率常数,只受温度影响,图2表示速率常数的对数lgA与温度的倒数之间的关系,A、B、D、E分别代表图1中a点、c点的速率常数,点表示a点的lgk正。


①若发生副反应C2H6(g)3H2(g)+2C(s),会降低催化效率,原因是。
②某温度下,若只存在副反应:2CO2(g)+C2H6(g)4CO(g)+3H2(g)。向a L密闭容器中充入2.1 mol C2H6和2.2 mol CO2 , t min后反应达到平衡,容器内C2H4为1.4 mol,CO2为0. 2 mol,则C2H6的平衡总转化率为% (保留三位有效数字)。
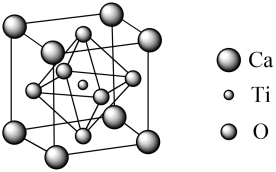
①的空间构型是。
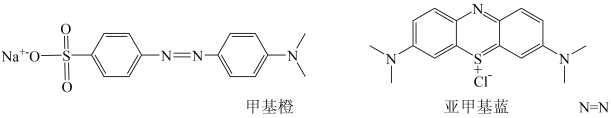
②甲基橙、亚甲基蓝中C原子的杂化类型有,
③常温下,CO2、HCHO在水中溶解度之比大约是1:500,其主要原因是。
(a)苯环上有2个取代基;
(b)能发生银镜反应;
(c)能与FeCl3发生显色反应。
其中核磁共振a谱有5组峰,且峰面积之比为6:2:2:1:1的同分异构体的结构简式为。