

选项 | 被提纯的物质 | 杂质 | 除杂试剂 | 除杂方法 |
A | 乙酸乙酯 | 乙酸 | 氢氧化钠 | 分液 |
B | MgCl2(aq) | Fe3+(aq) | MgO(s) | 过滤 |
C | CO2(g) | SO2(g) | 饱和NaHCO3、浓H2SO4 | 洗气 |
D | Na2CO3(s) | NaHCO3(s) | / | 加热 |


已知:①“混合焙烧”后烧渣含MnSO4、Fe2O3及少量FeO、Al2O3、MgO。
②金属离子在水溶液中沉淀的pH范围如下表所示(25℃):
物质 | Fe(OH)3 | Fe(OH)2 | Mn(OH)2 | Al(OH)3 |
开始沉淀的pH | 1.9 | 7.6 | 7.3 | 3.0 |
完全沉淀的pH | 3.2 | 9.6 | 9.3 | 5.2 |
③离子浓度≦10-5mol·L-1时,离子沉淀完全。
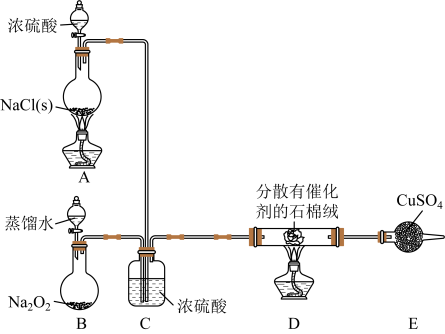
请回答下列问题:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O。
当有0.4mol电子发生转移时,得到的还原产物为mol。
方法二:实验室常用氯酸钾(KClO3)、草酸(H2C2O4)和硫酸溶液共热制备。有同学设计如下装置制备ClO2并用其处理含锰离子的工业废水。
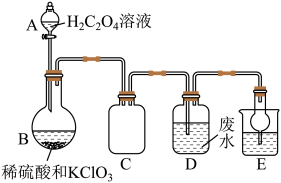
①C装置的作用为。
②B中反应的离子方程式:。
反应Ⅰ:CO2(g)+3H2(g)CH3OH(g)+H2O(g),ΔH1=-49.58kJ·mol-1
反应Ⅱ:CO2(g)+H2(g)CO(g)+H2O(g),ΔH2
反应Ⅲ:CO(g)+2H2(g)CH3OH(g),ΔH3=-90.77kJ·mol-1
回答下列问题:

化学式 | AgCl | AgBr | AgI | Ag2S | Ag2CrO4 |
颜色 | 白色 | 浅黄色 | 黄色 | 黑色 | 红色 |
Ksp | 1.8×10-10 | 5.4×10-13 | 8.3×10-17 | 6.3×10-50 | 2.0×10-12 |
①向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时=。
②测定水体中氯化物的含量,常用标准硝酸银法进行滴定,滴定时,应加入的指示剂是。
A.KBr B.KI C.K2S D.K2CrO4
 )是一种饲料添加剂,能溶于NaOH溶液中,常含有H3AsO3、NaCl等杂质。回答下列问题:
)是一种饲料添加剂,能溶于NaOH溶液中,常含有H3AsO3、NaCl等杂质。回答下列问题:


①遇FeCl3溶液显紫色;②苯环上的一氯取代物只有两种
→→→