选项 | 实验目的 | 实验操作及现象 | 实验结论 |
A | 检验硫酸厂周边空气是否含有SO2 | 用注射器多次抽取空气,慢慢注入盛有酸性KMnO4稀溶液的同一试管中,溶液不变色 | 空气中不含SO2 |
B | 证明CH3COOH是弱电解质 | 用pH计分别测量醋酸溶液和盐酸的pH,醋酸溶液的pH大 | CH3COOH是弱电解质 |
C | 探究淀粉的水解程度 | 向淀粉水解液中加入NaOH溶液调节溶液至碱性,并分成两份,向第一份中加入银氨溶液并水浴加热出现银镜;向第二份中滴加少量碘水,溶液变蓝色 | 淀粉部分水解 |
D | 探究卤素单质Cl2、Br2和I2的氧化性强弱 | 向NaBr溶液中通入过量氯气,溶液变橙色,再滴加淀粉KI溶液,溶液变蓝色 | 氧化性:Cl2>Br2>I2 |

已知:

Li极催化剂 | 碳化钼(Mo2C) | Au和多孔碳 |
CO2的放电产物 | 草酸锂(Li2C2O4) | Li2CO3和C |


已知:Ksp(BaCO3)=5.1×10-9 , Ksp(BaCrO4)=1.2×10-10 , Ksp(CaCrO4)=2.3×10-2;“净化液”中溶质只含有NaVO3、Na2CrO4。
请回答下列问题:

I.将邻苯二甲酸酐(C8H4O3)与苯酚(C6H5OH)在b中混合,在剧烈搅拌下,缓慢滴加约2mL浓硫酸,加热至150℃进行反应,待b内固体反应物全部熔融为澄清的液态混合物后,停止加热。
II.装置冷却后,量取40mL稀硫酸,在揽拌下加入b中,从溶液中析出粗品酚酞后,抽滤混合物。
III.将粗品酚酞置于烧杯中,加适量水溶解,在不断搅拌下滴加饱和碳酸钠溶液。
IV.继续加入足量碳酸钠溶液,并加入适量水,搅拌。
V.抽滤烧杯中的混合物,洗涤滤渣,合并洗涤液,得到酚酞盐(A2-)溶液。
VI.将溶液转移至大烧杯中,在搅拌下滴加浓盐酸,直到红色褪去,出现白色浑浊,抽滤,滤渣为不溶的杂质。
VII.将滤液转移至大烧杯中,在搅拌下继续滴加浓盐酸,最终析出白色晶体,抽滤、洗涤得纯净的酚酞。
请回答下列问题:
4NH3(g)+3O2(g)=2N2(g)+6H2O(g) ΔH1
C3H8(g)+5O2(g)=3CO2(g)+4H2O(g) ΔH2=-2044kJ•mol-1
对于不同配比的燃料,定义过量空气系数为完全燃烧1kg燃料所实际供给的空气质量与所需的理论空气质量的比值。
请回答下列问题:
物质 | NH3(g) | H2O(g) |
ΔH(kJ•mol-1) | -46 | -242 |
则ΔH1=kJ•mol-1
I.4NH3(g)+5O2(g)=4NO(g)+6H2O(g) ΔH3<0,K1=8.5×1023(2065K)
II.4NH3(g)+6NO(g)=5N2(g)+6H2O(g) ΔH4<0,K2=7.0×1046(2065K)
III.N2(g)+O2(g)=2NO(g) ΔH5>0,ΔS>0
①反应III能自发进行的条件是。
②α分别为0.9、1.0、1.1时,烟气中CO排放浓度随氨体积分数变化的关系如图甲所示。α=0.9对应的曲线是(填“X”“Y”或“Z”),理由是。
③烟气中NO排放浓度随着氨的体积分数变化的关系如图乙所示。氨的体积分数大于10%时,NO排放浓度逐渐减低的原因为。

④丙烷中掺氨燃烧的优点是。

①基态As原子的核外电子排布式为[Ar]。
②雌黄中As—S—As键角(填“大于”“小于”或“等于”)S—As—S键角。
③雄黄和雌黄比砷的氧化物的毒性要小很多,除结构稳定性的原因之外,从物理性质的角度分析,还与其有关。
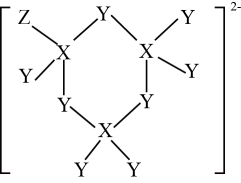
①青金石的结构中、S2-代替了方钠石中部分Cl—的占位,Ca2+代替了部分Na+的占位,则方钠石的化学式为。
②青金石中第三周期各元素的第一电离能由大到小的顺序为。
③青金石的颜色与骨架内填入的阴离子有关,其中一种重要阴离子是三硫自由基阴离子。研究表明,三硫自由基阴离子(II)可以通过多硫阴离子S(I)在高温下的均裂反应得到,并最终可能异构化为另一种S
的异构体(III),过程如下图:

关于I、II、III三种物质,下列说法正确的有(填字母)。
A.I中的S—S键都是σ键
B.II中的S原子最外层都满足8电子稳定结构
C.II的中心硫原子的杂化轨道类型为sp
D.与II互为等电子体
E.III一定为平面形结构

①该方解石结构中阴离子的空间构型为。
②设NA为阿伏加德罗常数的值,则该方解石晶体的摩尔体积Vm=m3•mol-1(列出算式)。

Click反应示例:
请回答下列问题:
a.最少有三个碳原子在一条直线上;
b.不含环状结构;
c.含有硝基和溴原子。
上述同分异构体中,在同一直线上的碳原子最多且含有手性碳(碳原子上连有4个不同的原子或基团时,该碳称为手性碳)的化合物的结构简式为。