
|
选项 |
实验操作 |
实验目的 |
|
A |
向肉桂醛( |
验证肉桂醛中含碳碳双键 |
|
B |
向待测液中先滴加氯水,再滴加KSCN溶液 |
检验溶液中是否含有 |
|
C |
用pH试纸分别测定等浓度的 |
比较 |
|
D |
常温常压下,向两份相同锌粒中,分别加入体积相同、浓度不同的稀硫酸,记录收集相同体积 |
探究浓度对化学反应速率的影响 |


回答下列问题:
①用离子方程式表示“滤液a”呈酸性的原因。
②根据下图所示的溶解度曲线,将“滤液a”蒸发结晶、、洗涤、干燥,得NH4Cl固体。

实验I.向MnO2中加入H2O2溶液,产生大量气泡;再加入稀H2SO4 , 固体未明显溶解。
实验II.向MnO2中加入稀H2SO4 , 固体未溶解;再加入H2O2溶液,产生大量气泡,固体完全溶解。
①实验I中MnO2的作用是,实验II中H2O2的作用是。
②由实验可知,“酸浸”溶解MnO2时加入试剂的顺序是。
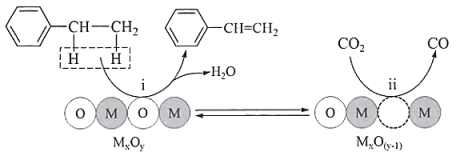
该机理可表示为以下两个基元反应,请补充反应ⅱ:
ⅰ:
;
ⅱ:.
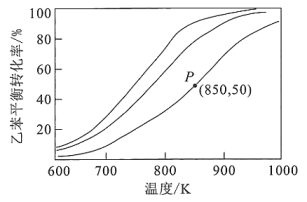
①乙苯平衡转化率相同时,投料比越高,对应的反应温度越(填“高”或“低”)。
②相同温度下,投料比远大于10∶1时,乙苯的消耗速率明显下降,可能的原因是:
ⅰ.乙苯的浓度过低;
ⅱ.。
③850K时,反应经t min达到图中P点所示状态,若初始时乙苯的物质的量为n mol,则v(苯乙烯)=。

请回答下列问题:
①滴定终点现象是。
②则NaC3N3O3Cl2的含量为。(用含m,c,V的代数式表示)
①P与N同主族,其最高价氧化物对应水化物的酸性:HNO3H3PO4(填“>”或“<”),从结构的角度说明理由:。
②P与N的氢化物空间构型相似,PH3键角NH3键角(填“>”“<"或“=”)。
A.离子键 B.金属键 C.氢键 D.共价键 E.配位键

已知原子O、A的分数坐标为(0,0,0)和(1,1,1),原子B的分数坐标为,若该晶体密度为dg·cm-3 , 则铜镍原子间最短距离为pm(列出计算式,设NA为阿伏加德罗常数的值)

①存在-NO2与苯环直接相连,且不存在-O-O-键。
②不同化学环境的氢原子数目比为1:2:6。
 的合成路线流程图(无机试剂和有机溶剂任选,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任选,合成路线流程图示例见本题题干)。