 B .
B .  C .
C .  D .
D . 
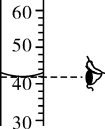 读取浓硫酸的体积
B .
读取浓硫酸的体积
B .  稀释浓硫酸
C .
稀释浓硫酸
C .  加入碳酸钠
D .
加入碳酸钠
D .  倾倒稀硫酸
倾倒稀硫酸






①KNO3中混有少量NaCl,提纯KNO3可采用的方法是。
②10℃时,将等质量的KNO3、NaCl固体,分别加入到盛有100g水的两个烧杯中,搅拌,充分溶解,现象如图2所示。烧杯中一定是饱和溶液的是(填“KNO3”或“NaCl”)溶液。
③Ca(OH)2溶解度曲线如图3所示,将A点对应的Ca(OH)2溶液溶质质量分数增大,可采取的具体操作是。
泡菜品种繁多、风味独特、口感鲜脆。新鲜蔬菜中含有硝酸盐,硝酸盐对人体无直接危害,但转化成亚硝酸盐后,就会对人体产生危害。亚硝酸盐【如亚硝酸钠(NaNO2)】与胃酸(主要成分是盐酸)反应,产生亚硝酸(HNO2)和氯化物(如NaCl)。亚硝酸不稳定,产生的二氧化氮进入血液与血红蛋白结合,会导致人中毒。
如图为室温下,食盐水浓度和泡制时间与芹菜泡制过程中亚硝酸盐含量的关系曲线。

用不同的蔬菜进行测定,亚硝酸盐含量变化趋势与芹菜相似。泡菜发酵过程中,泡制温度较高时,亚硝酸盐含量最大值出现得早,且数值低,这与温度较高有利于乳酸菌的繁殖有关。泡制过程中添加姜汁和维生素C,都能有效地减少亚硝酸盐的生成,现代医学证明,泡菜中的乳酸和乳酸菌对人体健康有益,具有抑制肠道中的腐败菌生长、降低胆固醇等保健作用。但是,有些泡菜盐分或糖分过高,对高血压和糖尿病等慢性病患者不利。另外,泡制过程也会造成某些营养素的流失。
请依据文章回答下列问题:



取四枚大小相同的洁净无锈铁钉分别放入试管。进行图1实验,现象如下表。

试管编号 | A | B | C | D |
一周后铁钉表面现象 | 有一层铁锈 | 无明显变化 | 无明显变化 | 有较厚铁锈 |
对比A、B、C试管中实验现象,说明铁锈蚀是与空气中的发生化学反应。

小组设计了图2装置,检查气密性,将5g铁粉和2g碳粉加入三颈烧瓶,t1时刻加入2mL饱和NaCl溶液后,再将一只装有5mL稀盐酸的注射器插到烧瓶上(此时没有推动注射器活塞),采集数据。
据图3分析,说明铁生锈(填“放热”或“吸热”),t2~t3这段时间反应并未停止但温度却开始降低,原因是。
连接如图5装置。取部分生锈的铁粉(铁和氧化铁的混合物)0.6g于锥形瓶中,加入足量稀盐酸进行实验。完全反应后,测得生成气体体积为0.2L,已知该条件下氢气密度为0.09g/L,根据以上数据,请计算该固体中铁的质量分数。(写出计算过程)

a.装置的气密性不好 b.铁与盐酸反应放热
c.装置内原来的空气没有排掉 d.没有扣掉加入的盐酸的体积

【拓展问题】
废液呈红色,说明废液显性。使废液变成红色的物质是什么?
【做出猪想】
猜想一:只有Na2CO3
猜想二:只有NaOH
猜想三:NaOH和Ca(OH)2
猜想四:NaOH和Na2CO3
猜想五:NaOH、Ca(OH)2和Na2CO3
你认为以上猜想中,不合理的猜想除了猜想五外,还有。
【查阅资料】CaCl2溶液呈中性。
【验证猜想】
静置一段时间后,取少量废液缸中的上层红色清液于试管中,加入过量CaCl2溶液,观察到,由此证明了猜想四成立。