A | B | C | D |
|
|
|
(经酸化3%NaCl溶液) |
蒸干AlCl3溶液制无水AlCl3固体 | 实验室制乙炔 | 实验室制备Fe(OH)3胶体 | 在Fe表面生成蓝色沉淀,无法验证Zn保护了Fe |


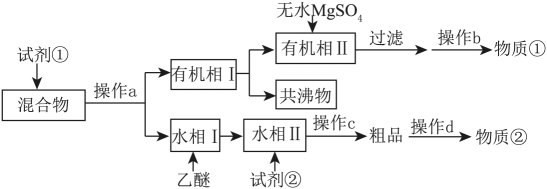
已知:苯甲酸乙酯的沸点为212.6℃,乙醚-环己烷-水共沸物的沸点为62.1℃,苯甲酸100℃会迅速升华

选项 | 实验 | 实验器材 | 试剂 |
A | 配制100mL一定物质的量浓度的NaCl溶液 | 100mL容量瓶、胶头滴管、烧杯、量筒、玻璃棒 | 蒸馏水、NaCl固体 |
B | 测定酸碱滴定曲线 | 酸式滴定管、碱式滴定管、滴定管夹、烧杯、锥形瓶、铁架台 | 0.1000mol•L-1NaOH溶液、0.1000mol•L-1盐酸溶液、甲基橙 |
C | 淀粉水解产物检验 | 试管、胶头滴管、酒精灯 | 淀粉溶液、10%NaOH溶液、2%CuSO4溶液 |
D | 证明Ksp(CuS)<Ksp(ZnS) | 试管、胶头滴管 | 0.10mol•L-1CuSO4溶液、0.10mol•L-1ZnSO4溶液、1mol•L-1Na2S溶液 |

例如:冠醚Z可与KMnO4发生如图所示的变化:

下列说法正确的是

已知:PbCl2难溶于冷水,易溶于热水;PbCl2(s)+2Cl-(aq)PbCl
(aq) △H>0;Ksp(PbSO4)=1×10-8 , Ksp(PbCl2)=1.25×10-5。下列说法错误的是

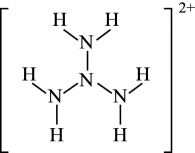
物质 | 肼 | 偏二甲肼 |
熔点 | 1.4℃ | -58℃ |
沸点 | 113.5℃ | 63.9℃ |
二者熔沸点差异较大的主要原因是。
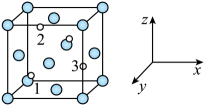

已知:
①钯常见的化合价有+2和+4价。钯容易形成配位化合物,如[Pd(NH3)4]Cl2、[Pd(NH3)2]Cl2、[H2Pd(NO3)4]。
②当有硝酸存在时,钯易与硝酸形成稳定的配位化合物。
回答下列问题:
已知:
i.2S+Cl2S2Cl2 , S2Cl2+Cl2
2SCl2;
ii.常温下,S2Cl2是一种浅黄色的油状液体,易挥发,在空气中可剧烈水解,产生白雾并伴有刺激性气味;
iii.相关物质的熔沸点:
物质 | S | S2Cl2 | SCl2 |
熔点/℃ | 112.8 | -77 | -121 |
沸点/℃ | 444.6 | 137 | 59 |
如图所示:

S2Cl2的电子式为。
①向mg样品中加入适量蒸馏水,加热蒸出全部气体,用足量的NaOH溶液充分吸收、再用cmol•L-1盐酸标准溶液以酚酞作指示剂(亚硫酸钠溶液pH在指示剂变色范围内)滴定剩余的NaOH,达到滴定终点时消耗盐酸溶液V1mL。
②做对照实验:不加样品,其余操作保持不变重复上述实验,达到滴定终点时消耗盐酸溶液V0mL。样品纯度为。
a.锥形瓶洗涤干净后未干燥
b.做样品滴定实验时,滴定前无气泡,滴定后有气泡
c.做对照实验时,滴定后俯视滴定管读数
d.蒸馏水中溶有较多的CO2

①可与碳酸氢钠溶液反应
②可以使溴水褪色
③苯环上为二取代,其中氯原子直接连接在苯环上
写出其中核磁共振氢谱五组峰,比值为2:2:2:2:1的同分异构体的结构简式。
写出以 为原料制备
为原料制备 的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
的合成路线流程图(无机试剂和有机溶剂任用,合成路线流程图示例见本题题干)。
反应I:![]() (g)+H2(g)
(g)+H2(g)![]() (g) △H1=-100.3kJ•mol-1
(g) △H1=-100.3kJ•mol-1
(g)反应II:![]() (g)+H2(g)
(g)+H2(g)![]() (g) △H2=-109.4kJ•mol-1
(g) △H2=-109.4kJ•mol-1
反应III:![]() (g)+
(g)+![]() (g)
(g)2
![]() (g) △H3
(g) △H3
已知:选择性=×100%
回答下列问题:

A.催化剂活性降低 B.平衡常数变大 C.反应活化能减小

①曲线B在T1温度下恰好达到平衡时的点的坐标为(m,n),则m(填“>”、“<”或“=”)2,由图像计算n的取值范围是。
②T2温度下,若某时刻容器内气体的压强为起始时的1.5倍,则此时v(正)(填“>”、“<”或“=”)v(逆)。