





电离平衡常数 | Ka1 | Ka2 |
H2CO3 | 4.5×10-7 | 4.7×10-11 |
CH3COOH | 1.75×10-5 | —— |
操作 | 现象 | 结论 | |
A | 往Fe2(SO4)3溶液中加入Cu片 | 溶液由棕色变为蓝色 | Fe3+的氧化能力比Cu2+强 |
B | 向某溶液样品中加入浓NaOH溶液并加热,将湿润的红色石蕊试纸靠近试管口 | 试纸变蓝 | 溶液样品中含 |
C | 常温下,向2mL0.1mol•L-1MgSO4溶液中加入2mL0.1mol•L-1NaOH溶液,再滴加5~6滴0.1mol•L-1CuSO4溶液 | 先产生白色沉淀,后部分白色沉淀变为蓝色 | 相同温度下Ksp:Cu(OH)2<Mg(OH)2 |
D | 将食品脱氧剂样品中的还原铁粉溶于盐酸,滴加KSCN溶液 | 溶液呈浅绿色 | 食品脱氧剂样品中没有+3价铁 |

①氢原子与其它原子之间存在的作用力类型有。
②已知:当Cu(II)配合物A和B配位构型由八面体转变为四方平面时,吸收光谱蓝移,配合物颜色由紫色变为橙色(如图所示)。

若将配合物的颜色由紫色调整为橙色,需要进行的简单操作为。


物质 | 熔点/℃ | 沸点/℃ | 性质 |
PCl3 | -112 | 75.5 | 遇水生成H3PO3和HCl,与O2反应生成POCl3 |
PCl5 | — | 约100℃升华 | 遇水生成H3PO4和HCl,与红磷反应生成PCl3 |
I.利用如图所示装置制取少量PCl3(部分夹持装置已略去)。
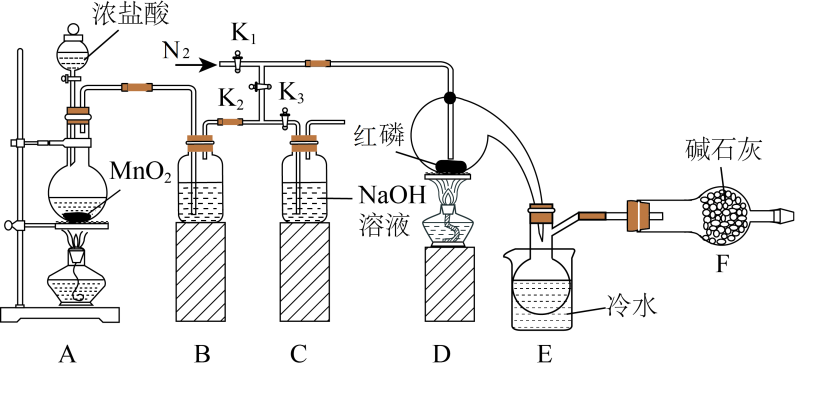
实验步骤:
①迅速称取mg产品,加水反应后配成100mL溶液。
②取上述溶液10.00mL,向其中加入V1mLc1mol/L碘水(足量),充分反应。
③向②所得溶液中加入几滴淀粉溶液,逐滴滴加c2mol/L的Na2S2O3溶液并振荡,当溶液恰好由蓝色变为无色时,记录所消耗Na2S2O3溶液的体积。
④重复②、③操作3次,平均消耗Na2S2O3溶液V2mL。
第①步溶于水的化学反应方程式是。

