
选项 | 劳动项目 | 化学知识 |
A | 科学研究:燃煤脱硫 | 增大煤燃烧放出的热量 |
B | 工厂生产:冶炼钢铁 | 涉及氧化还原反应 |
C | 社会服务:推广使用免洗手酒精消毒液 | 酒精消毒液酒精能使蛋白质变性 |
D | 家务劳动:饭后用热的纯碱溶液洗涤餐具 | 油脂在碱性条件下发生水解 |


|
|
|
|
A.过滤 | B.排空气法收集 | C.混合浓硫酸和乙醇 | D.溶液的转移 |


物质 | ||||
相关数据 |

①基态Se原子的核外电子排布式为[Ar]。
②该新药分子中有种不同化学环境的H原子。
③SeO的空间构型为。

①基态Fe2+的价电子轨道表示式为。
②富马酸分子中σ键与π键的数目比为。
③富马酸亚铁中各元素的电负性由大到小的顺序为。

①1molM能与足量NaHCO3反应放出2molCO2
②核磁共振氢谱有三组峰
 为原料制备
为原料制备 的合成路线(无机试剂任选)。
的合成路线(无机试剂任选)。

已知:
①TiO2+2C+2Cl2TiCl4+2CO
②TiCl4为无色或淡黄色液体,熔点为-30℃,沸点为136.4℃,极易与水反应
③PdCl2的盐酸溶液可吸收CO而生成黑色颗粒Pd
回答下列问题:
①MnO2 ②KMnO4 ③浓H2SO4
写出其中发生的离子反应方程式。
①先打开分液漏斗活塞,一段时间后,再陶瓷管通电加热
②先陶瓷管通电加热,一段时间后,再打开分液漏斗活塞
③先陶瓷管断电停止加热,一段时间后,再关闭分液漏斗活塞
④先关闭分液漏斗活塞,一段时间后,再陶瓷管断电停止加热
①氮气 ②氧气 ③水蒸气 ④氩气
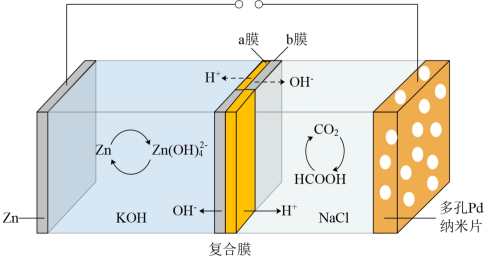
Ⅰ.我国科学家研发的水系可逆Zn-CO2电池可吸收利用CO2 , 将两组阴离子、阳离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的H2O解离成H+和OH- , 工作原理如图所示:
Ⅱ.科学家使CH4和CO2发生重整反应:CH4(g)+CO2(g)2CO(g)+2H2(g) △H=+247kJ•mol-1。生成合成气CO和H2 , 以实现CO2的循环利用。该反应中,如何减少积碳,是研究的热点之一。某条件下,发生主反应的同时,还发生了积碳反应:
CO岐化:2CO(g)CO2(g)+C(s) △H1=-172kJ•mol-1
CH4裂解:CH4(g)C(s)+2H2(g) △H2=+75kJ•mol-1
