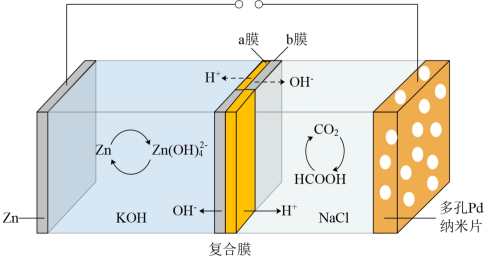
Ⅰ.我国科学家研发的水系可逆Zn-CO2电池可吸收利用CO2 , 将两组阴离子、阳离子复合膜反向放置分隔两室电解液充、放电时,复合膜间的H2O解离成H+和OH- , 工作原理如图所示:
Ⅱ.科学家使CH4和CO2发生重整反应:CH4(g)+CO2(g)2CO(g)+2H2(g) △H=+247kJ•mol-1。生成合成气CO和H2 , 以实现CO2的循环利用。该反应中,如何减少积碳,是研究的热点之一。某条件下,发生主反应的同时,还发生了积碳反应:
CO岐化:2CO(g)CO2(g)+C(s) △H1=-172kJ•mol-1
CH4裂解:CH4(g)C(s)+2H2(g) △H2=+75kJ•mol-1
