|
|
|
|
|
|
A.宇航服 |
B.汽车轮胎 |
C.口罩的聚丙烯熔喷布 |
D.螺纹钢 |
 C . 氯原子的结构示意图:
C . 氯原子的结构示意图: D . 四氯化碳的电子式:
D . 四氯化碳的电子式:







【可选试剂:稀硝酸、溶液、酸性
溶液、
溶液、
溶液、
溶液】

由图中曲线变化可知,该反应为(填“放热”或“吸热”)反应,破坏旧键需要吸收的能量为(填“E1”、“E2”、“E1+E2”或“E2-E1”下同),破坏cmolC的化学键需要吸收的能量为。

该反应的化学方程式为:;
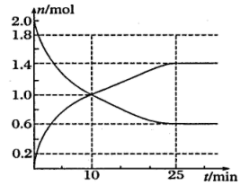
下列叙述不能判断该反应达到平衡状态的是;
①容器中压强不再改变; ②容器中气体密度不再改变;
③O2的物质的量浓度不再改变; ④SO3的质量不再改变;
下列说法错误的是
①电池放电时通入空气的电极为负极;
②电池放电时,电解质溶液的碱性逐渐减弱;
③电池放电时每消耗3.2gH2转移3.2mol电子。

①
②
③
④
⑤
其中⑤的二氯代物有种。