


已知:酸性条件下Cu+不稳定
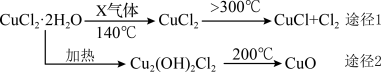
下列说法错误的是
实验 | 试剂 | 现象 | |
试管 | 滴管 | ||
| 2mL[Ag(NH3)2]Cl溶液 | 6滴0.1 mol∙L−1KCl溶液 | I中无明显现象 |
6滴0.1 mol∙L−1KI溶液 | II中产生黄色沉淀 | ||
6滴0.1 mol∙L−1HCl溶液 | III中产生白色沉淀 | ||
6滴饱和KCl溶液 | IV中产生白色沉淀 | ||
下列说法错误的是

选项 | 实验目的 | 实验过程 |
A | 检验某铁的氧化物含二价铁 | 将该氧化物溶于浓盐酸,滴入KMnO4溶液,紫色褪去 |
B | 检验乙醇中含有水 | 向乙醇中加入一小粒金属钠,产生无色气体 |
C | 证明酸性:H2SO3>HClO | 在Ca(ClO)2溶液中通入SO2 , 产生白色沉淀 |
D | 证明:CO2有氧化性 | 将点燃的镁条,迅速伸入盛满CO2的集气瓶中,产生大量白烟且瓶内有黑色颗粒产生 |

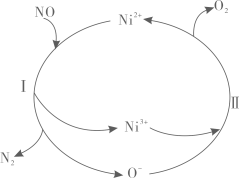
Ⅰ.4NH3(g)+5O2(g)4NO(g)+6H2O(g)
Ⅱ.4NH3(g)+3O2(g)2N2(g)+6H2O(g)
现将1molNH3、1.45molO2充入1L恒容密闭容器中,在上述催化剂作用下反应,相同时间内有关生成物物质的量随温度变化曲线如图所示:

已知:有效转化率=×100%
下列说法错误的是

①色胺酮分子中所含元素(H、C、N、O)电负性由大到小的顺序为。
②色胺酮分子中N原子的杂化类型为。
③X射线衍射分析显示色胺酮钴配合物晶胞中还含有一个CH3OH分子,CH3OH是通过作用与色胺酮钴配合物相结合。

①距离Mg原子最近的Ni原子有个。
②已知该晶胞的边长为anm,阿伏加德罗常数为NA , 该晶体的密度为g•cm-3。(1nm=10-9m)

①装置A中盛放烧碱溶液的仪器名称为。
②装置B的作用为。
③装置C中发生反应的化学方程式为。
④已知相关物质的溶解度如表:
溶解度/g物质 | 25℃ | 100℃ |
NaCl | 37 | 39 |
NaH2PO2 | 100 | 667 |
充分反应后,将A、C中溶液混合,再将混合液(含极少量NaOH)加热浓缩,有大量杂质晶体析出,然后(填操作名称),得到含NaH2PO2的溶液,进一步处理得到粗产品。
取1.00g粗产品配成100mL溶液,取25.00mL于锥形瓶中,酸化后加入30.00mL0.100mol•L-1碘水,充分反应。然后以淀粉溶液作指示剂,用0.100mol•L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液24.00mL,有关反应的方程式为:H2PO+H2O+I2=H2PO
+2H++2I— , 2S2O
+I2=S4O
+2I- , 则产品纯度为(NaH2PO2式量88)。
①不存在顺反异构 ②结构中含有酚羟基 ③苯环上有两个取代基且位于间位
 →
→

项目 | 废水水质 | 排放标准 |
pH | 1.0 | 6~9 |
Cu2+含量/(mg•L-1) | 72 | ≤0.5 |
NH | 2632 | ≤15 |
资料2:Cu(OH)2+4NH3[Cu(NH3)4]2++2OH-
①根据实验结果分析,处理废水中Cu2+的最佳pH约为。
②结合资料解释实验结果图中b到d段曲线所示的过程。
已知:实验条件空气的影响忽略不计。
序号 | 实验操作 | 现象 |
I | 向附有少量银镜的试管中,加入5mL0.1mol•L-1Fe(NO3)3溶液(过量,pH=2),振荡试管 | 银镜慢慢消失,溶液澄清 |
对银镜的消失原因小组同学作出如下假设:
假设1:Fe3+具有氧化性,能氧化Ag;
假设2:……。
回答下列问题:
①补全假设2:。
②甲同学通过设计实验,证明了假设2成立,他设计的方案为:向附有少量银镜的试管中,加入,充分振荡,银镜消失。
③为证明假设1,乙同学用同浓度FeCl3溶液替换Fe(NO3)3溶液,进行下列实验:
序号 | 实验操作 | 现象 |
II | 向附有少量银镜的试管中,加入5mL0.1mol•L-1FeCl3溶液(过量,pH=2),振荡试管 | 银镜快速溶解,反应后溶液中有明显灰色沉淀 |
丙同学查阅文献得知:Fe3+氧化性与Ag+接近,实验II中银镜能快速溶解,可能与生成氯化银沉淀有关,用平衡移动原理解释原因。
④为证明自己的观点,丙同学的通过积极思考,设计了实验III。
实验III:如图连接装置进行实验,电压表的指针向左偏转,记录电压示数为a。

已知:电压大小反映了物质氧化性与还原性强弱的差异;物质氧化性与还原性强弱的差异越大,电压越大。
将U形管右侧溶液替换成0.1mol•L-1NaNO3溶液,重做上述实验,电流表指针向左偏转,记录电压示数为b,能证明丙同学观点的实验证据是。
序号 | 实验操作 | 现象 |
IV | 向附有少量银镜的试管中,加入5mL1mol•L-1的HBr溶液,不断振荡。 | 银镜不溶解 |
V | 向附有少量银镜的试管中,加入5mL1mol•L-1的HI溶液,不断振荡。 | 银镜溶解,有黄色沉淀产生,且有气泡产生 |
已知:常温下Ksp(AgBr)=5.4×10-13;Ksp(AgI)=8.5×10-17 , 分析相同条件下银镜能溶于5mL1mol•L-1的HI溶液,而不溶于HBr溶液的原因。