 B .
B .  C .
C .  D .
D . 
| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前质量(g) | 10 | 16 | 0 | 0 |
| 反应中质量(g) | m2 | 1.6 | ||
| 反应后质量(g) | m1 | 0 | 15.2 | 6.4 |
| 物质 | X | Y | Z | Q |
| 反应前质量/g | 20 | 20 | 20 | 20 |
| 反应后质量/g | 20 | a | 16 | 14 |
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量/g | 20 | 4 | 20 | 20 |
反应后质量/g | 2 | 待测 | 32 | 26 |
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量(g) | 10 | 16 | 0 | 0 |
反应中质量(g) | m2 | 1.6 | ||
反应后质量(g) | m1 | 0 | 15.2 | 6.4 |

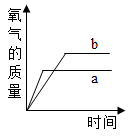 B .
B . 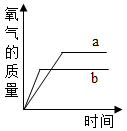 C .
C . 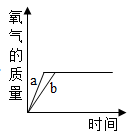 D .
D . 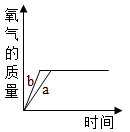


①15克石灰石最多产生CO2气体的质量;
②所加入稀盐酸的溶质质量分数。

①从b端通入氮气; ②从分液漏斗中滴加适量水;
③从a端通入二氧化碳;④将石蕊溶液染成的紫色的干燥纸花放入广口瓶中;
⑤从a端通入氮气; ⑥从b端通入二氧化碳。
请写出该实验操作(步骤可以重复使用)最合理的顺序是
限选控制反应速率的方法:a.反应物的浓度;b.反应物的状态。
限选试剂:A.稀盐酸;B.浓盐酸;C.块状石灰石;D.碳酸钠溶液;E.粉末状石灰石。
①填写下表并回答相关问题。
|
实验名称 |
控制速率的方法 |
所选用的最佳试剂 |
|
灭火器反应原理 |
a |
和D |
|
CO2的实验室制法 |
|
A和C |
②写出实验室制取CO2反应原理的化学方程式: 。

实验一:水槽中滴入紫色石蕊试液,将收集满两种气体的试管同时倒立于其中,片刻后实验现象如图所示,说明相同条件下的溶解性:SO2(填“>”或“<")CO2 , 试管内溶液变成色。
实验二:已知镁条在CO2中剧烈燃烧的化学方程式为2Mg+CO2 2MgO+C。试推测镁条在SO2中燃烧的现象:剧烈燃烧,。
|
实验序号 |
温度(℃) |
大理石颗粒 |
盐酸质量分数(%) |
实验目的 |
|
1 |
20 |
粗 |
5 |
探究大理石和盐酸的反应速度与石灰石颗粒大小的关系 |
|
2 |
20 |
细 |
5 |

|
|
烧杯+盐酸 |
大理石 |
充分反应后烧杯+剩余物 |
|
甲 |
75.0g |
25.0g |
95.6g |
|
乙 |
75.0g |
30.0g |
100.6g |
|
丙 |
95.0g |
25.0g |
115.6g |
若甲、乙、丙三同学中有一名同学所取的大理石和盐酸恰好完全反应,请回答下列问题.
①将一定量的蛋壳放人容器中;②往其中加入适量的稀盐酸,观察到有较多的气泡产生;③……;④得出结论:蛋壳的主要成分是碳酸盐(如:碳酸钙)。
|
蛋壳的质量/克 |
加入稀盐酸质量/克 |
收集到CO2气体体积/升 |
|
7.5 |
100 |
1.1 |
假设二氧化碳全部是由蛋壳中的碳酸钙与盐酸反应产生,小明计算这些蛋壳中碳酸钙的质量分数的过程如下:
解:设该蛋壳中碳酸钙的质量为x
| CaCO3+2HCl=CaCl2+H2O+ | 2CO2↑ |
| 100 | 28 |
| x | 1.1升 |
100:28=x:1.1升
x=3.93,
蛋壳中碳酸钙的质量分数 =0.524
小明的计算过程中存在明显错误,请你通过列式进行计算(保留1位小数)。
请回答:



| 时间/分 | 0 | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 |
| 大理石碎屑生成的 CO2 质量/克 | 0 | 1.45 | 1.75 | 1.98 | 2.18 | 2.30 | 2.36 | 2.40 | 2.40 | 2.40 |
| 块状大理石生成的 CO2 质量/克 | 0 | 0.45 | 0.80 | 1.10 | 1.36 | 1.60 | 1.81 | 1.98 | 2.11 | 2.20 |
【问题】稀盐酸滴入 Na2CO3 溶液中,为什么一开始不产生气泡?
【猜想】根据质量守恒定律和复分解反应分析,稀盐酸滴加到 Na2CO3 溶液中,先生成了 NaHCO3 和另一种盐 ★;
【查阅资料】NaHCO3 易受热分解:2NaHCO3═Na2CO3+CO2↑+H2O
【实验】为验证反应中是否有NaHCO3 生成,进行如下实验:
①取一定量的 Na2CO3 溶液,逐滴滴入稀盐酸,刚好有气泡产生就停止滴入。
②将①中所得溶液在低温下蒸发至固体 M 完全析出。
③按如图装置加热分解固体 M,并把加热产生的气体通入烧杯内A 试液中。
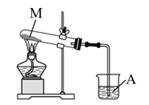
【现象与结论】实验③过程中观察到试管口有液滴和 A 试液变浑浊,证实稀盐酸逐滴滴入 Na2CO3 溶液中先生成了 NaHCO3。
【反思交流】

| 加入稀盐酸的次序 | 1 | 2 | 3 | 4 |
| 加入稀盐酸的质量(克) | 10 | 10 | 10 | 10 |
| 剩余固体的质量(克) | 4.0 | m | 1.2 | 1.2 |
求:
实验方法是:均匀称取七份样品分别和稀盐酸反应(CaCO3+2HCl=CaCl2+H2O+CO2↑),用电子天平及有关装置进行实验,实验数据记录如下表。(其他物质既不溶于水也不跟酸反应)
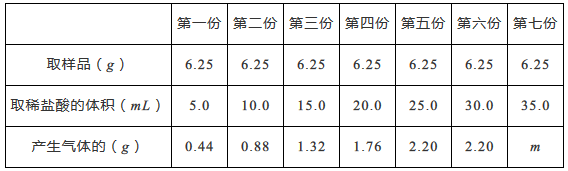
通过对数据的分析和比较,回答下列有关问题


|
实验次序 |
实验一 |
实验二 |
实验三 |
实验四 |
|
鸡蛋壳的质量/g |
10 |
10 |
10 |
10 |
|
加入盐酸的质量/g |
10 |
20 |
30 |
40 |
|
反应后溶液总质量/g |
18.9 |
m |
36.7 |
46.7 |
请计算:
①CH4+H2O CO+3H2
②2CH4+O2 2CO+4H2
从原料配比角度比较方法①和②,更适宜用于合成甲醇的方法是(填序号)。
 甲
甲 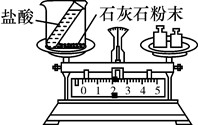 乙
乙 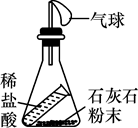 丙
丙