物质 | 苹果汁 | 西瓜汁 | 牛奶 | 鸡蛋清 | 炉具清洁剂 |
pH | 2.9 | 5.8 | 6.4 | 7.6 | 12.5 |


选项 | 实验操作和现象 | 结论 |
A | 将锌粒放入CuSO4溶液中,表面析出红色物质 | 金属活动性:Zn > Cu |
B | 将燃着的木条伸入集气瓶中,木条熄灭 | 集气瓶中气体为 N2 |
C | 向氢氧化钠溶液中滴加盐酸,无明显现象 | 该过程中未发生反应 |
D | 将某气体通过灼热的黑色氧化铜固体,固体变红 | 该气体为氢气 |
 图甲:称取一定质量的粗盐
B .
图甲:称取一定质量的粗盐
B .  图乙:溶解粗盐
C .
图乙:溶解粗盐
C .  图丙:过滤溶解粗盐所得的悬浊液
D .
图丙:过滤溶解粗盐所得的悬浊液
D .  图丁:蒸干过滤所得的溶液
图丁:蒸干过滤所得的溶液


序号 | 温度 / ℃ | CO2流速(个气泡 / 秒) | 出现浑浊的时间 |
1 | 25 | 2~5 | 5 分 17 秒 |
2 | 25 | 5~8 | 5 分 27 秒 |
3 | 25 | 10~13 | 5 分 02 秒 |
4 | 40 | 5~8 | 3 分 48 秒 |
5 | 50 | 5~8 | 1 分 36 秒 |

已知:“脱硫”时发生的主要反应有。
下列说法错误的是( )
①可用(填试剂名称)检测某白醋的酸性。
②水瓶内的水垢主要含 CaCO3、Mg(OH)2 , 可用白醋去除。Mg(OH)2去除时发生反应的化学方程式是。

①60℃时(填“能”或“不能”)配得 90%的蔗糖溶液。
②将 20℃时氯化钠的饱和溶液蒸发掉 50 g 水,理论上得到氯化钠的质量是g。

①1 个 Ca2+可以交换出个 Na+。
②结合水瓶内水垢的成分,家庭日常生活中软化硬水常用的方法是。
营养成分 | 维生素C | 蛋白质 | 脂肪 | 糖类 | 钙 | 铁 | 水 |
质量 | 145 mg | 1.3 g | 0.3 g | 2.3 g | 56 mg | 1.2 mg | 94.5 g |
①在青菜所含营养成分钙、铁中,属于人体微量元素得是(填元素符号)。
②经常摄入适量营养素,可预防得坏血病。

①孔雀石属于(填“纯净物”或“混合物”)。可将 Cu2(OH)2CO3表示为 2CuO·xCO2·H2O,其中 x 的数值为。
②将孔雀石粉碎后放入炼炉内,上面覆盖适量木炭,生火后鼓风至火候足够,可得精炼铜液(冷却为初铜)。反应过程中需将木炭适度“架空”,其目的是。
③得到的初铜经提炼、融合(加入金属锡、铅)成青铜。该青铜(填“属于”或“不属于”)合金。

①将铁矿石与煤炭进行熔炼,流出的铁水冷凝后即为生铁。高温时赤铁矿(主要含 Fe2O3)与 CO 发生反应的化学方程式是。
②将生铁于高温下反复捶打可得到钢。根据下表,从物质组成角度,分析此法炼钢的主要原理是。
生铁 | 钢 | |
含碳量% | 2~4.3 | 0.03~2 |
①煅烧时发生反应的类型是。
②此“灰”淋水后可用作船只和墙缝的填缝剂,该填缝剂的化学式是,在空气中最终转化为。
①电解水可制取氢气,装置如图所示,常温下 a 管内气体的体积是 10 mL,b 管内气体的化学式是。

②经测量,b 管内气体的体积略小于理论值。可能的原因是(填序号)
A.常温下 H2的溶解度小于 O2的溶解度
B.b 管内产生了 O3
C.水槽中 KOH 的浓度偏小,导致溶液导电能力偏弱
③催化剂条件下,可利用太阳能分解水来制取氢气。与电解水制取氢气相比,从能量的角度,分析该方法制取氢气的优点是。

已知:
①温度低于 2000℃时,体系内 H2O 含量没有改变,其原因是。
②曲线 A、B 对应的微粒是原子,曲线 A 对应的微粒是(填化学式)。
③从元素守恒角度分析,曲线 A、B 所对应原子的个数比是。
①一种镁铜合金可用于储氢。将镁、铜单质按质量比为 3∶4 的比例在一定温度下熔炼得到镁铜合金。该镁铜合金的化学式是。
②该镁铜合金完全吸氢后所得混合物与过量盐酸充分反应,整个过程中释放出 H2的量应为的之和。

①光合作用可以实现 CO2的固定,光合作用主要是将光能转化为能
②有机物 A 燃烧的方程式为。A 的化学式为。
③CO2的水溶液能使紫色石蕊试液变红,其原因是过程中生成了(写化学式)。
①CaO 在捕集 CO2时,当 CaO 剩余 40%时,捕集能力明显降低,主要原因是。
②写出 CO2释放时反应的化学方程式:。

①400~600 ℃时释放出气体的化学式为。欲使 CaC2O4·H2O 全部分解生成 CaO,需要控制的条件是。
②相同温度和压强时,分别向含CO2的密闭体系中加入不同方法制备的CaO固体,捕集一定量的CO2所需的时间如下表:
反应所需的时间 | 10 g CaO(热分解 CaCO3制备) | 10 g CaO(热分解 CaC2O4·H2O 制备) |
吸收 1 g CO2 | 15 秒 | 7 秒 |
吸收 5 g CO2 | 45 秒 | 23 秒 |
吸收 10 g CO2 | 132 秒 | 68 秒 |
由上表可知:由热分解CaC2O4·H2O制备的CaO具有更好的CO2捕集性能,其可能的原因是。
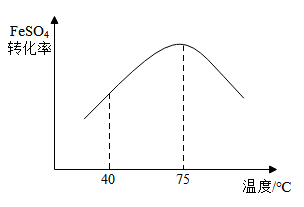
①40~ 75℃范围内,随着温度的升高,FeSO4转化率增大的原因可能是。
②温度大于 75℃,随着温度的升高,FeSO4转化率减小。某同学猜想其主要原因是 H2O2 受热分解,请设计实验证明该同学的猜想:。

①“煅烧”时,装置甲发生了某个反应,该反应生成 3 种氧化物。装置乙中 KMnO4溶液褪色,装置丙中澄清石灰水变浑。装置甲发生反应的化学方程式是。
②经检验,500℃下加热装置甲中反应后的固体,可得到一种只含硫且相对分子质量为 192 的气体。该气体的化学式是。
③反应后,测量装置乙溶液中的含量的测定,请补充完整实验方案:取适量反应后装置乙中的液体,,过滤、、干燥,得一定质量的 BaSO4沉淀。(须使用的试剂有:BaCl2溶液、蒸馏水)