 电池供电
B .
电池供电
B .  葡萄酿酒
C .
葡萄酿酒
C .  塑料降解
D .
塑料降解
D .  干冰升华
干冰升华
 B .
B .  C .
C .  D .
D . 

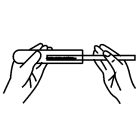 取氧化铜粉末
B .
取氧化铜粉末
B . 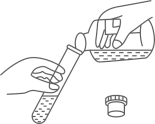 倾倒稀硫酸
C .
倾倒稀硫酸
C . 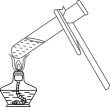 加热混合物
D .
加热混合物
D .  熄灭酒精灯
熄灭酒精灯

选项 | 实验现象 | 解释 |
A | 打开“雪碧”汽水瓶盖,产生气泡 | 气体的溶解度随着压强减小而减小 |
B | 在积雪的公路上撒盐,冰雪很快融化 | 盐水的沸点较高 |
C | 木炭在空气中燃烧发出红光,在氧气中燃烧发出白光 | 燃烧剧烈程度跟O2含量有关 |
D | 向盛有NaOH固体的试管中加水,试管外壁有热感 | NaOH固体溶于水放热 |




扬州干丝天下一绝:干丝作为豆制品提供的主要营养成分为(填“淀粉”或“蛋白质”),除此还含一定量的钙,钙元素(填“属于”或“不属于”)人体所需微量元素,适量补充钙可以预防(填字母)。
A.骨质疏松 B.甲状腺疾病 C.侏儒症
扬州城市大公园:享受生态之“绿”—绿色植物通过作用让城市成为宜居氧吧。该作用将能转化为化学能。
A.无机材料 B.合成材料 C.复合材料
“烟花三月下扬州”,三月的扬州花红柳绿,香气扑鼻。从微粒角度解释“香气扑鼻”的主要原因是____(填字母)。
扬州水源地水质各项常规指标如下:(数据来源于扬州生态环境局官网,2023年3月27日)
取水点 | pH | 溶解氧(mg/L) | 高锰酸盐指数(mg/L) | 氨氮(mg/L) |
廖家沟新城水源地 | 8.12-8.30 | 9.14 | 2.5 | 0.11 |
长江瓜州水源地 | 8.00-8.15 | 9.12 | 3.0 | 0.09 |
①两地水源都呈(填“酸”或“碱”)性。
②溶解氧中的“氧”是指(用化学符号表示)。
③(填表格中一项常规指标)含量过高,会导致水体富营养化。
④下列图标是我国“国家节水标志”的是(填字母)。
A . B.
B. C.
C. D.
D.
农业上常用16%的NaCl溶液选种。实验室配制50g溶质质量分数为16%的NaCl溶液。
①用托盘天平称取 gNaCl固体。
②用量筒量水时,采用如图所示观察方式,则所配溶液的溶质质量分数(填“<”“>”或“=”)16%。该操作还需要的仪器是(填仪器名称)。

③最后将NaCl溶液转移到试剂瓶中,贴上标签(如图),在标签上可以不必注明的是(填字母)。

A 50g B.16% C.NaCl溶液
大多数天然淡水需要经过处理方可直接饮用。
①“生命吸管”将大运河水转变为饮用水的过程示意图如下:

“活性炭”可去除异味,是因为它具有良好的性。“离子交换树脂”将硬水软化的反应之一是: , 由此可知一个Ca2+可交换出(填数字)个Na+。
②城市集中供热厂锅炉长期使用会形成水垢,可用盐酸去除。写出水垢中Mg2(OH)2CO3与盐酸发生反应的化学方程式。


铁生锈是(填“剧烈”或“缓慢”)氧化。
一段时间后,仔细观察试管b中铁钉,发现也有锈蚀现象。为此大家又设计了如下实验。
[实验1]将涂水的铁片置于植物油中,并放置于密封的无氧容器中,一天后观察铁片无锈迹。
[实验2]将涂水的铁片置于植物油中,并敞口放置于空气中,一天后发现少量锈斑,再过一段时间观察,锈斑面积增大。
植物油(填“能”或“不能”)完全隔绝空气中的氧气。
已知:CO2在水中的逸出速率大于溶解速率,故也可用排水法收集CO2。
图二中仪器①的名称,发生装置有一处明显的不正确。
①分析图三,可得出植物油不能完全将CO2与水隔离,可以(填“加快”或“减缓”)CO2在水中的溶解。
②取量筒内的液体少量于试管中,滴加(填试剂名称),溶液变红色,说明显酸性。

组别 | 矿酸比 | 硫酸浓度(%) | 温度(℃) | 锂元素浸出率(%) |
A | 1:1 | 90 | 100 | 70.34 |
B | 1:1 | 98 | 100 | 73.89 |
C | 1:1 | 98 | 150 | 78.24 |
D | 1:3 | 98 | 200 | 85.53 |
①本实验中 (填“BC”或“CD”)两组实验对比能说明温度对锂元素的浸出率有影响。
②根据A组和B组实验对比,得出硫酸浓度对锂元素浸出率的影响是:其它条件相同时,。

【实验原理】锌与CuSO4溶液、锌与稀H2SO4的反应。
锌与CuSO4溶液反应的方程式为:;
①组装仪器, 。
②装药品,调节量气装置两边液面相平,读数。
③将CuSO4溶液滴入装有mg锌粉三颈烧瓶中并搅拌,充分反应后,再滴加稀H2SO4至不再有气体产生。
④冷却至室温,调节量气装置两边液面相平,读数。
请将上述实验步骤补充完整。

【实验原理】CuSO4溶液与BaCl2溶液反应。
【实验步骤】

判断加入BaCl2溶液是否过量的最佳方法是____,然后观察现象判断。