 B .
B .  C .
C .  D .
D . 
 取用固体
B .
取用固体
B . 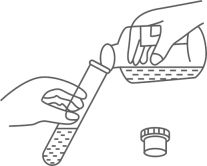 倾倒盐酸
C .
倾倒盐酸
C .  点燃酒精灯
D .
点燃酒精灯
D . 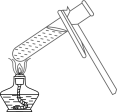 加热液体
加热液体



选项 | 实验目的 | 实验方法 |
A | 鉴别NaOH和Ca(OH)2溶液 | 分别向溶液通入CO2气体,观察现象 |
B | 除去NaCl固体中少量Na2CO3 | 加入过量的稀盐酸,反应停止后蒸发结晶 |
C | 检验敞口放置的NaOH是否变质 | 取样溶解,滴加澄清石灰水后观察现象 |
D | 分离CaCO3和CaCl2固体混合物 | 溶解、过滤、洗涤、烘干 |
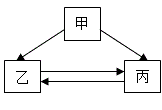
①若甲为单质,乙、丙均为化合物,则甲可能是C
②若甲、乙的组成元素完全相同,则丙能供给呼吸
③若甲为酸,乙为氢气,则乙→丙只能通过化合反应来实现
④若甲可用来改良酸性土壤,丙是石灰石的主要成分,则乙只能为氯化钙

①P点的含义是。
②t2℃时,三种物质溶解度由大到小依次为。
③t2℃时,40g的a物质加入到50g的水中充分搅拌,形成的溶液的质量为g。
④若a物质中混有少量b物质,提纯a物质的方法是(填“降温结晶”或“蒸发结晶”)。

①滴入溶液体积为V2mL时,溶液中溶质为(填化学式)。
②用来改良酸性土壤的碱是(填物质俗称)。
①2个氮原子:。
②3个氢气分子:。
③Mg2+中“2”的含义:。

①反应前将石英砂进行粉碎,其目的是。
②反应①中体现了焦炭的性。
③用于制造光导纤维的高纯二氧化硅,可利用反应②制备,同时生成一种气体单质,该反应的化学方程式为。
④由三氯甲硅烷(HSiCl3)转变为纯硅时,反应要在无氧环境中进行的原因是(写一条)。

A.当导管口刚有气泡冒出时
B.当导管口停止冒出气泡时
C.当导管口有连续均匀气泡冒出时
资料Ⅰ:草酸(H2C2O4)能和KMnO4溶液反应,使之褪色。反应方程式如下:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+10CO2↑+8H2O。
资料Ⅱ:硫酸锰(MnSO4)可作草酸和KMnO4溶液反应的催化剂。
实验一:探究温度和硫酸浓度对该反应反应速率的影响
取A、B、C三支试管,分别向每支试管中先加入4mL0.1%的KMnO4溶液和0.4mL浓硫酸,再加入1mL草酸溶液,记录KMnO4褪色时间如下表。
序号 | 浓硫酸浓度 | 草酸溶液 | 温度 | KMnO4褪色时间 |
A | 65% | 0.1% | 室温 | 129 s |
B | 65% | 0.1% | 50℃ | 16 s |
C | 98% | 0.1% | 室温 | 72s |
同学甲设计实验证明了MnSO4能催化草酸和KMnO4溶液反应,补全该实验方案:取试管D,室温下加入4mL0.1%的KMnO4溶液和0.4mL98%浓硫酸,。
试计算: