 取液
B .
取液
B .  加热
C .
加热
C . 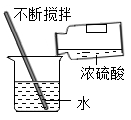 稀释
D .
稀释
D . 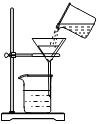 过滤
过滤


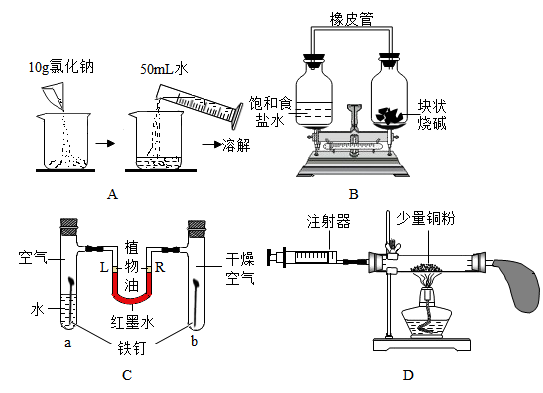


选项 | 实验目的 | 实验方案 |
A | 分离炭粉和铁粉的混合物 | 加入足量稀硫酸,过滤、洗涤,干燥 |
B | 鉴别NaOH和NH4NO3固体 | 分别溶于水中,测量溶液温度的变化 |
C | 除去NaCl固体中少量的NH4Cl | 加入Ca(OH)2固体,研磨 |
D | 验证CO中混有的少量CO2 | 通入灼热的氧化铜 |

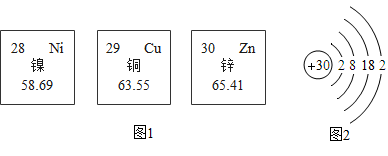

已知镍元素常见化合价为+2,在反应①、②中任选一个,书写其反应的化学方程式。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | |
溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 |
NH4Cl | 29.4 | 33.3 | 37.2 | 41.4 | 45.8 | 50.4 | |

A.两种溶液中溶剂的质量相等
B.两种溶液中溶质质量分数相等
C.t℃大于20℃



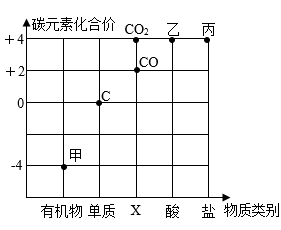
据此分析,x=,mgNaCl不饱和溶液中水的质量为g。

实验 | A | B | C |
操作 | 加了酚酞的氢氧化钠溶液中滴加稀硫酸 | 向集气瓶中注入氢氧化钠溶液 | 向澄清石灰水中滴加碳酸钠溶液 |
现象 | 溶液呈红色 | 小气球 | 产生白色沉淀 |
请你补充完整并进行交流:
A.NaNO3 B.CuSO4 C.NH4NO3 D.KNO3
你选择的依据是。

①防倒吸尾气处理:利用E装置可吸收的气体具有的典型性质是。
②干燥气体:碱石灰是氧化钙与氢氧化钠的固体混合物,下列气体中不可用F装置制取并干燥的气体是。
A.H2 B.O2 C.CO2
③制取气体:实验室科可利用G装置制取氢气,其突出的优点是。

a.升高 b.降低 c.既升高又降低
【探究目的】所得粗锌产品中含有哪些杂质?单质锌的质量有多少?
【提出猜想】反应后的固体中一定含有生成物。从物质的质量关系与反应进行程度分析,所得固体中可能还含有剩余的反应物。
【设计实验】同学们经讨论设计实验装置如下(忽略其他因素对结果的影响),回答下列问题:

【实施操作】①如图连接好装置后,装入药品前,首先应进行的操作是。
②A装置试管中加入足量稀硫酸充分反应后,仍有少量黑色固体剩余。B装置中澄清石灰水变浑浊,此时A装置中发生反应的化学方程式为(只写一个),B装置的作用是。
③C装置收集的气体为(化学式)。
【定性结论】综合以上实验可知,粗锌中含有的杂质有。
【定量研究】实验结束后,若D处一共收集到200.0mL液体,则2.0g粗锌中含有单质锌的质量为g。(已知此温度下C装置收集的气体的密度ρ≈0.1×10-3g/mL)
计算: