|
选项 |
实验目的 |
实验及现象 |
结论 |
|
A |
比较CH3COO-和 |
分别测浓度均为0.1mol·L-1的CH3COONH4 和NaHCO3溶液的pH,后者大于前者 |
Kh(CH3COO-)〈Kh( |
|
B |
验证蔗糖水解产物 |
向盛有1mL 20%蔗糖溶液的试管中滴入3-5滴稀硫酸,将混合液煮沸几分钟、冷却,在冷却后的溶液中加入银氨溶液 |
有银镜产生 |
|
C |
探究氢离子浓度对 |
向K2CrO4溶液中缓慢滴加硫酸,黄色变为橙红色 |
增大氢离子浓度,平衡向生成 |
|
D |
比较AgCl和AgI的溶度积常数 |
向NaCl、NaI 的混合液中滴加2滴0.1mol/LAgNO3溶液,振荡,沉淀呈黄色 |
Ksp (AgI)<Ksp( AgCl) |
 苯环上的一氯代物有7种
B . 化学式为C5H12O2的二元醇有多种同分异构体,主链上有3个碳原子的二元醇,其同分异构体数目是(不包括1个碳原子上连接2个羟基的化合物): 1种
C . 化学式为C9H12含有苯环的同分异构体有8种
D . 研究表明禽流感病毒H7N9在沸水中两分钟就能被杀死,是因为病毒所含蛋白质受热变性
苯环上的一氯代物有7种
B . 化学式为C5H12O2的二元醇有多种同分异构体,主链上有3个碳原子的二元醇,其同分异构体数目是(不包括1个碳原子上连接2个羟基的化合物): 1种
C . 化学式为C9H12含有苯环的同分异构体有8种
D . 研究表明禽流感病毒H7N9在沸水中两分钟就能被杀死,是因为病毒所含蛋白质受热变性

 ),阴极的主要电极反应式为
),阴极的主要电极反应式为

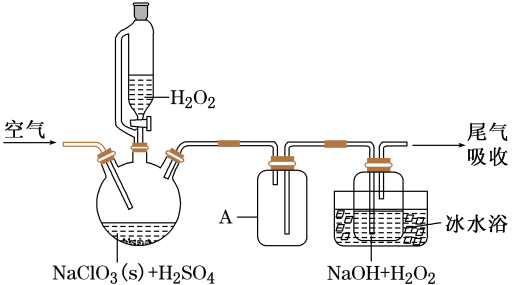
已知:2NaClO3+H2O2+H2SO4=2ClO2 ↑+O2↑+Na2SO4+2H2O
2ClO2+H2O2+2NaOH=2NaClO2+O2↑+2H2O
ClO2熔点-59℃、沸点11℃; H2O2沸点150℃
请回答:
①(用离子方程式表示);
②H2O2+Cl2= 2Cl-+O2+2H+。
I.在锥形瓶中加入足量的碘化钾,用50mL蒸馏水溶解后,再加入3mL稀硫酸;
Ⅱ.再向该锥形瓶中加入20.00 mL自来水;
Ⅲ.用0.0001 mol ·L-1 Na2S2O3溶液滴定测定锥形瓶中生成I2的量。(已知:I2+2=2I-+
),共用去20.00 mL Na2S2O3溶液。
计算可得自来水水样中ClO2的含量为mg/L(精确到0.01)。
I.2CO2 (g) +6H2(g)CH3OCH3(g) +3H2O(g) ΔH1= - 122. 5kJ/mol
Ⅱ.CO2(g) +H2(g)CO(g) +H2O(g) ΔH2=+41.1kJ/mol
①在压强、CO2和H2的起始投料一定的条件下,发生反应I、Ⅱ,实验测得CO2平衡转化率和平衡时CH3OCH3的选择性随温度的变化如图所示。(已知:CH3OCH3的选择性=)

其中表示平衡时CH3OCH3的选择性的曲线是(填“①”或“②”);温度高于300℃时,曲线②随温度升高而升高的原因是。
②对于反应Ⅱ的反应速率v=v正- v逆=k 正p(CO2)·p(H2) - k逆p(CO)·p(H2O),其中k正、k逆分别为正、逆反应速率常数,p为气体的分压(分压=总压 ×物质的量分数)。
a.降低温度,k正- k逆(填 “增大”“减小”或”不变”);
b.在一定温度和压强下的反应Ⅱ,按照n(H2):n(CO2)=1:1投料,CO2转化率为50%时 v(正):v(逆)=3:4,用气体分压表示的平衡常数Kp=。
已知: 25℃,H2CO3 Ka1=4.5×10-7 Ka2=4.7 ×10-11; H2S Ka1=1.1 ×10-7 Ka2=1.3 ×10-13。请写出H2S与足量碳酸钠溶液反应的离子方程式:。

反应原理是:(i) Cl- 在阳极转化为Cl2;
(ii) Cl2在碱性溶液中歧化为ClO-;
(iii) ClO-将二甲胺氧化为N2 , 和H2O。
①写出电解池中阴极发生反应的方程式。
②电解池中选择阴离子交换膜而不选择阳离子交换膜的原因是。
③当阴极区收集到6.72L (标况下) H2时,阳极区收集到N2的体积(标况下)是L。


①CuFeS2中各元素电负性数值从小到大的顺序为,晶胞中S原子的杂化方式为。
②晶胞中Cu和Fe的投影位置如图所示,设阿伏加德罗常数的值为NA , 则该晶体的密度为g·cm-3。
