

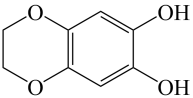
 互为同分异构体
互为同分异构体
某科研小组探究Fe与能否直接反应的实验如下:
实验1:取加热至沸腾并快速冷却的溶液(加热、冷却过程中溶液颜色无变化)于试管中,并加入1mL的苯,再加入铁粉,长时间无蓝色沉淀出现。
实验2:在“实验1”中,若使用砂纸打磨过的铁粉,一会儿就出现蓝色沉淀。
实验3:在“实验1”中,若加少量NaCl,立即出现蓝色沉淀;若换成加入或
;则不出现蓝色沉淀。
实验4:在“实验1”中,若将铁粉换成在稀硫酸中反应一段时间的铁片,立即出现蓝色沉淀。
下列说法错误的是
选项 | 目的 | 方案设计 | 现象和结论 |
A | 探究温度对化学平衡的影响 | 将2mL0.5mol/L的CuCl2溶液加热后置于冷水中,观察现象 | 若溶液由黄绿色变为蓝绿色,说明降低温度,[Cu(H2O)4]2++4Cl- |
B | 检验食品脱氧剂中还原铁粉是否已变质 | 取脱氧剂包装内固体粉末于试管中,加足量稀盐酸溶解,充分反应后滴加KSCN溶液,振荡,观察溶液颜色变化 | 若溶液未变红色,说明脱氧剂中还原铁粉没有变质 |
C | 比较CH3COO-和ClO-水解程度大小 | 用pH试纸分别测定同浓度CH3COONa和NaClO溶液的pH | 若测得CH3COONa溶液pH大,说明CH3COO-水解程度大于ClO- |
D | 探究电石与水的反应 | 将电石与饱和食盐水反应产生的气体通入酸性高锰酸钾溶液,观察现象 | 若酸性高锰酸钾溶液褪色,说明电石与水反应生成了乙炔 |
已知:25℃时,难溶电解质的溶度积常数如表所示:
难溶电解质 | Cu(OH)2 | Mn(OH)2 | Al(OH)3 |
Ksp | 2.2×10−20 | 4×10−14 | 1.9×10−33 |

①写出PbS反应的离子方程式:。
②浸取时应控制盐酸的浓度。其他条件一定,若盐酸浓度过大,铅元素的浸出率反而下降,原因是。

过程Ⅰ中,Fe2+催化过程可表示为:
i:2Fe2++PbO2+4H++=2Fe3++PbSO4+2H2O
ii:2Fe3++Pb+=2Fe2++PbSO4
下列实验方案可证实上述催化过程。请将实验方案补充完整。
a.向酸化的FeSO4溶液中加入KSCN溶液,溶液几乎无色,再加入少量PbO2 , 溶液变红。
b.。

①Y极与电源(填“正极”或“负极”)相连。
②该离子交换膜为膜。
③X极的电极反应式为。


①比较不同路径,路径1能垒较低的原因是的键能大于的键能。
②15min时反应速率突然加快的原因是。
运−20的外壳大量使用了AM系列Mg−Al−Mn,铝的价电子排布图为,第一电离能铝(填“大于”、“等于”或“小于”)镁,镁原子核外有种不同运动状态的电子。

钨元素位于第六周期第VIB族,价电子排布的能级与Cr相同,但排布方式与Cr有所不同,请写出钨原子的价层电子排布式。

 命名。
命名。
a.含苯环的单环化合物;
b.苯环上只有一个取代基;
c.核磁共振氢谱有四组峰,且峰面积之比为3:2:2:1。