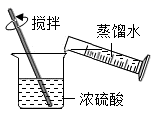
 稀释浓硫酸
B .
稀释浓硫酸
B . 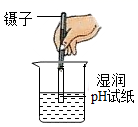 测稀硫酸的pH
C .
测稀硫酸的pH
C . 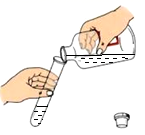 倾倒稀硫酸
D .
倾倒稀硫酸
D . | 选项 | 问题 | 分析与设计 |
| A | 为何变质 | 2NaOH + CO2 = Na2CO3 + H2O |
| B | 是否变质 | 取样,加入足量稀盐酸,观察是否产生气泡 |
| C | 是否全部变质 | 取样,加入足量氯化钙溶液,观察产生沉淀多少 |
| D | 如何除去杂质 | 取样,加入适量氢氧化钙溶液,过滤 |
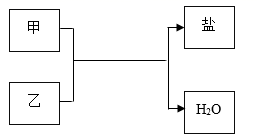
| 选项 | 甲 | 乙 |
| A | Fe2O3 | 稀硫酸 |
| B | SO3 | NaOH溶液 |
| C | 稀盐酸 | Ca(OH)2溶液 |
| D | 稀盐酸 | AgNO3溶液 |
a.KNO3
b.CO(NH2)2
c.K2SO4
d.Ca3(PO4)2

①如果用稀硫酸除去铁锈的化学方程式为。其基本类型为反应。
②工厂废气处理时,用石灰浆吸收SO2(性质与CO2相似)的化学反应方程是。
③实验室中含有盐酸的废水倒入下水道会造成铸铁管道腐蚀,其理由为:(用化学方程式解释)。

实验步骤 | 实验现象 | 实验结论 |
分别用a、b、c三支试管取样,各加入一定量碳酸钠溶液 | a中有气泡产生 | a中物质是稀盐酸 |
b中无明显现象 | b中物质是食盐水 | |
c中 | c中物质是澄清石灰水 |
写出a试管中发生反应的化学方程式。把c试管反应后的物质进行过滤,得到滤液。
猜想一:Na2CO3和NaOH;猜想二:NaOH;猜想三:。提示:Ca(OH)2微溶于水。
|
实验步骤 |
实验现象 |
实验结论 |
|
取一定量滤液于试管中,加入一种盐溶液(写溶质化学式)。 |
有白色沉淀 |
猜想一正确 |
写出上述有白色沉淀生成的化学方程式。
同学们还对a试管反应后废液的酸碱性感兴趣,决定用pH试纸测定其pH值
|
用pH试纸测定a试管反应后废液酸碱性的过程 |
测定结果 |
|
在白瓷板上放一小片pH试纸,用玻璃棒蘸取。 |
pH<7(废液显酸性) |

假设和现象 | 判断和化学方程式 | |
a | 若现象I为无氨味。 | 则样品中不含(填名称)。 |
b | 由操作②现象判断。 | 该样品一定含有(离子符号)。 |
c | 若现象Ⅲ为白色沉淀,现象Ⅳ为无沉淀。 | 则样品中含有(写名称),该反应的化学方程式为。 |
d | 若现象Ⅲ为“无沉淀”,现象Ⅳ为白色沉淀。 | 则样品中含有(写化学式),该反应的化学方程式为。 |

