|
A |
B |
C |
D |
|
验证非金属性强弱:C>Si |
实验室制Fe(OH)2 |
吸收氨气并防止倒吸 |
比较NaHCO3和Na2CO3溶解度 |
|
|
|
|
|


选项 | 事实 | 推测 |
A | Mg与冷水较难反应,Ca与冷水较易反应 | Be(铍)与冷水更难反应 |
B | 铬(Cr)的金属性位于锌和铁之间 | 铬能与稀盐酸发生反应 |
C | HCl在1500℃时分解,HI在230℃时分解 | HBr的分解温度介于二者之间 |
D | H2O的沸点比H2S的高 | H2S的沸点比H2Se的高 |

该样品的有效氯= ×100%
通过计算判断该样品的有效氯约为
氨很容易加压液化,常作为制冷剂,从物质结构上解释NH3容易液化的主要原因:。

NH3催化氧化的化学方程式是。
①甲观察到装置F中有红棕色气体,生成红棕色气体的化学方程式是。
②乙观察到装置F中只有白烟生成,白烟的成分是(写化学式)。
③用离子方程式解释装置G中溶液变成蓝色的原因:。
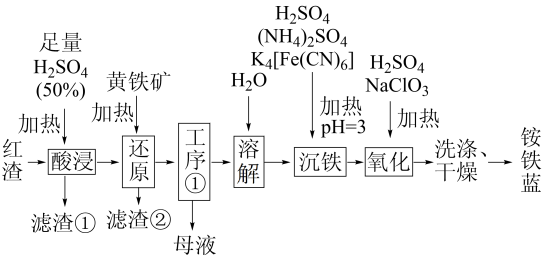
已知:K4[Fe(CN)6]溶液中存在的主要离子为K+和[Fe(CN)6]4-;NA为阿伏加德罗常数
回答下列问题:

分液漏斗和烧瓶用导管连接可使稀硫酸顺利流下,也可防止产生实验误差,若没有该导管将导致测定结果(填“偏大”“偏小”或“无影响”)。测定装置的接口从左至右正确的连接顺序是。
实验方案 | 产生的现象 |
I.取烧瓶中的反应液加入少量MnO2粉末 | 有大量气泡逸出 |
II.向NaOH稀溶液中加入2~3滴酚酞溶液,然后加入少量的反应液 | 溶液先变红后褪色 |
III.向反应液中加入2~3滴酚酞溶液,充分振荡,然后逐滴加入过量的NaOH稀溶液 | 开始无明显现象,加NaOH溶液先变红后褪色 |
在上述实验中,能够证明乙组分析正确的最佳方案是(填实验序号)。根据上述实验可知,反应溶液中存在的中间产物与酚酞作用的条件是。
元素 | 8O | 16S | 34Se | 52Te |
单质熔点/℃ | -218.4 | 113 | 450 | |
单质沸点/℃ | -183 | 444.6 | 685 | 1390 |
元素主要化合价 | -2 | -2,+4,+6 | -2,+4,+6 | |
原子半径 | 逐渐增大 | |||
单质与H2反应情况 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接化合 |
请总结表中知识规律,并依据元素周期律回答下列问题:
i.将含硒阳极泥与浓硫酸混合焙烧,产生SO2、SeO2的混合气体
ii.用水吸收i中混合气体,可得Se固体
①写出步骤ii中的化学方程式:。
②下列说法合理的是(填字母)。
a.SeO2既有氧化性又有还原性,其还原性比SO2强
b.浓硒酸可能具有强氧化性、脱水性
c.热稳定性:H2Se<HCl<H2S
d.酸性:H2SeO4<HBrO4<HClO4

已知TeO2微溶于水,易溶于较浓的强酸和强碱溶液。
①“碱浸”时发生反应的离子方程式为。
②碱浸后的“滤渣”可以部分溶于稀硝酸,发生反应的化学方程式是。
③“酸溶”过程中发生的化学方程式为:。