选项 | A | B | C | D |
文物 |
|
|
|
|
名称 | 西汉青铜雁鱼灯 | 秦代竹简 | 唐代兽首玛瑙杯 | 秦朝兵马俑 |
选项 | 操作或做法 | 目的 |
A | 将装有NO2的注射器的活塞往外拉 | 探究压强对平衡移动的影响 |
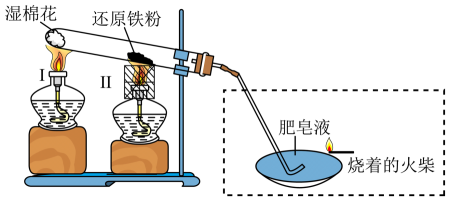
B | 常温下将铁丝插入浓硫酸中 | 制备SO2 |
C | 向溶有液溴的溴苯中加入足量NaOH溶液,振荡,静置后分液 | 提纯溴苯 |
D | 实验结束,将剩余白磷固体放回原试剂瓶 | 防止白磷自燃 |
选项 | 劳动项目 | 化学知识 |
A | 社区服务:回收旧衣物并按成分进行分类 | 棉、麻和丝主要成分均为纤维素 |
B | 家务劳动:柠檬煮水除去水壶中的水垢 | 柠檬酸可溶解碳酸钙等沉淀 |
C | 趣味实验:氨气可制作美丽喷泉 | 氨气极易溶于水 |
D | 学农活动:利用豆科植物作绿肥进行施肥 | 豆科植物可以实现自然固氮 |
元素 | X | Y | Z | W | T |
原子半径/nm | 0.160 | 0.143 | 0.102 | 0.071 | 0.099 |
主要化合价 | +2 | +3 | +6、-2 | -1 | -1 |
下列有关说法正确的是
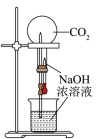 CO2做喷泉实验
B .
CO2做喷泉实验
B . 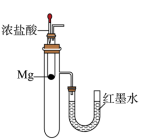 红墨水左高右低
C .
红墨水左高右低
C . 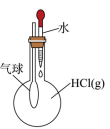 气球膨胀
D .
气球膨胀
D . 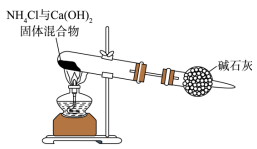 制取干燥氨气
制取干燥氨气
选项 | 陈述I | 陈述II |
A | SO2和氯气都能使品红褪色 | 两者都有漂白性 |
B | Al(OH)3是两性氢氧化物 | 盐酸和氨水能溶解Al(OH)3 |
C | 镁能与氮气发生反应 | 镁是活泼金属,有较强的还原性 |
D | 氯化氢气体不导电,盐酸导电 | 两者都属于电解质 |
 D . 向NaAlO2溶液中通入过量CO2:2
D . 向NaAlO2溶液中通入过量CO2:2
已知:气体分压(p分)=气体总压(p总)×体积分数。下列说法错误的是
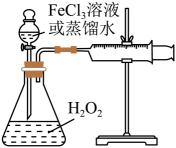
②设计实验方案:在不同条件下,测定。(要求所测得的数据能直接体现反应速率大小)
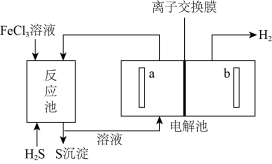
实验序号 | 10%H2O2/mL | 蒸馏水/mL | 0.2mol·LFeCl3溶液/mL | 现象 |
I | 10 | a | 0 | 无明显变化 |
II | 10 | b | 2 | 锥形瓶变热,溶液迅速变红棕色,并有较多气泡产生;2min时,反应变缓,溶液颜色明显变浅 |
III | 5 | 5 | 2 | 锥形瓶变热,溶液变棕色,开始5s后产生较少的气泡;2min时,反应速度加快 |
①表格中a=,b=。
②通过实验和(填写序号)探究浓度对反应速率影响。
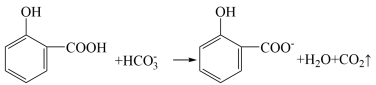
①反应i离子方程式为。
②某同学设计实验证明催化过程中有Fe2+产生:取2mLH2O2溶液于试管中,向试管中滴加2滴FeCl3溶液,再滴加2滴溶液,产生蓝色沉淀。
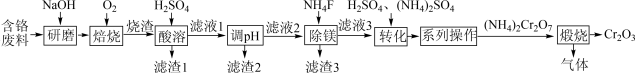
已知:烧渣的成分为Na2CrO4、NaAlO2、Na2SiO3、Fe2O3、MgO;25℃时,Ksp[Fe(OH)3]=4×10-38、Ksp[Al(OH)3]=1×10-33、Ksp[Mg(OH)2]=2×10-11 , 溶液中离子浓度≤10-5mol·L-1时,认为该离子沉淀完全。回答下列问题:
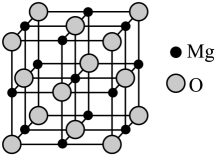
则每个Mg2+周围距离最近的Mg2+个数为。已知MgO晶胞边长为0.4nm,则MgO的密度为g/cm3(设NA为阿伏加德罗常数的值,只需列出算式)。
离子 | | | Cl- | ||
c/(mol·L-1) | 8.35×10-4 | 6.87×10-6 | 1.5×10-4 | l.2×10-5 | 3.4×10-3 |
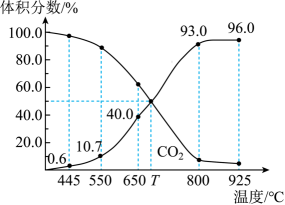
在不同温度下,NaClO2溶液脱硫、脱硝的反应中,SO2和NO的平衡分压pe如图所示。

①写出NaClO2溶液脱硫过程中主要反应的离子方程式。脱硫、脱硝反应的△H0(填“<”“>”或“=”)。
②已知脱硝主要反应为;4NO+3+4OH-=4
+3Cl-+2H2O。由实验结果可知,脱硫反应速率大于脱硝反应速率,原因是除了SO2和NO在烟气中的初始浓度不同,还可能是(写出其中一个原因)。欲提高烟气中NO的脱硝反应速率,可以采用的措施是(写出其中一条措施)。
③脱硝主要反应的平衡表达式为: , 其中pe(NO)为平衡分压。结合题目信息,计算298K时脱硫过程主要反应的化学平衡常数:K=(只列算式代入数据,不作运算)
序号 | 结构特征 | 反应的试剂 | 反应形成的新结构 | 反应类型 |
① | -CHO | Ag(NH3)2OH | ||
② |