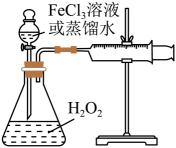
②设计实验方案:在不同条件下,测定。(要求所测得的数据能直接体现反应速率大小)
实验序号 | 10%H2O2/mL | 蒸馏水/mL | 0.2mol·LFeCl3溶液/mL | 现象 |
I | 10 | a | 0 | 无明显变化 |
II | 10 | b | 2 | 锥形瓶变热,溶液迅速变红棕色,并有较多气泡产生;2min时,反应变缓,溶液颜色明显变浅 |
III | 5 | 5 | 2 | 锥形瓶变热,溶液变棕色,开始5s后产生较少的气泡;2min时,反应速度加快 |
①表格中a=,b=。
②通过实验和(填写序号)探究浓度对反应速率影响。
①反应i离子方程式为。
②某同学设计实验证明催化过程中有Fe2+产生:取2mLH2O2溶液于试管中,向试管中滴加2滴FeCl3溶液,再滴加2滴溶液,产生蓝色沉淀。