①使用容量瓶前检查是否漏水;
②在容量瓶中溶解固体溶质;
③溶液需冷却至室温方可注入容量瓶;
④尽可能将溶质全部转移到容量瓶中;
⑤加水定容时,不小心超过刻度线,用胶头滴管吸出多余液体

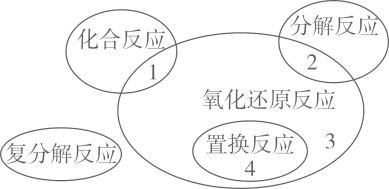
|
选项 |
实验操作及现象 |
结论 |
|
A |
向某溶液中加入稀盐酸,产生大量气体 |
该溶液中一定含有CO |
|
B |
向某溶液中加入AgNO3溶液,产生白色沉淀 |
该溶液中一定含有Cl﹣ |
|
C |
向某溶液中加入BaCl2溶液产生白色沉淀,再加入盐酸,沉淀不消失 |
该溶液中一定含有SO |
|
D |
向某溶液中加入浓NaOH溶液并加热,产生使湿润的红色石蕊试纸变蓝的气体 |
该溶液中一定含有NH |


|
物质 |
用途 |
|
A.氧化铁 |
a.作红色颜料 |
|
B.硝酸钾 |
b.作膨松剂 |
|
C.次氯酸钠 |
c.作肥料 |
|
D.碳酸氢钠 |
d.作消毒剂 |
①实验室通过加热NH4Cl和Ca(OH)2的混合物制取氨,该反应的化学方程式为 。
②工业上以氮气和氢气为原料合成氨,该反应的化学方程式为 。其中氮元素的化合价 (填“升高”或“降低”),反应中每生成2molNH3 , 消耗H2的物质的量是 mol。
③我国科研团队借助一种固体催化剂(LDH),在常温、常压和可见光条件下合成了氨,其过程如图所示。
该反应的化学方程式为 。反应中每转移6mole﹣ , 生成NH3的体积为 L(标准状况下)。

主要转化途径如下(转化所需试剂及条件已略去):N2→NO2→HNO3硝酸盐[如NH4NO3]。
①写出NO2→HNO3的化学方程式 。
②将HNO3转化为NH4NO3 , 列举两种不同类别的化合物M (写化学式)。
③NH4NO3常作为水培植物营养液的氮肥来源。若配制0.2mol/L的NH4NO3溶液480mL,需要NH4NO3固体的质量 g。

a.氧化性 b.还原性
资料:KSCN中S元素的化合价为﹣2价;酸性条件下,MnO的还原产物为Mn2+。

①i中溶液略微变红,说明待测液中存在 。
②ii中溶液颜色逐渐加深的原因是 (用离子方程式表示)。
③由实验一推测FeSO4固体变质的情况是 (填字母序号)。
a.未变质 b.部分变质 c.完全变质
针对“红色褪去”的现象,小组同学猜想可能的原因是 ,并通过如下实验证实了猜想。将褪色后的溶液分两份分别进行实验:
| 序号 | 操作 | 现象 |
| ① | 滴加NaOH溶液 | 产生红褐色沉淀 |
| ② | 滴加FeCl3溶液 | __▲_ |
请补全②中的现象:。
![]()
①可选作A的物质是 (填字母序号)。
a.Zn b.Cu c.Fe d.KI
②若消耗0.1mol/LKMnO4溶液3.6mL,则久置FeSO4固体中铁元素的质量分数是 。
资㺶:i.Mn2+在一定条件下被Cl2或ClO﹣氧化成MnO2(棕黑色)、MnO (绿色)、MnO
(紫色)。
ii.浓同条件下,MnO可被OH﹣还原为MnO
。
iii.Cl2的氧化性与溶液的酸碱性无关,NaClO的氧化性随碱性增强而减弱。
实验装置如图(夹持装置略):

| 序号 | Ⅰ | Ⅱ | Ⅲ |
| 物质a | 水 | 5%NaOH溶液 | 40%NaOH溶液 |
| 通入Cl2前C中实验现象 | 得到无色溶液 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 | 产生白色沉淀,在空气中缓慢变成棕黑色沉淀 |
| 通入Cl2后C中实验现象 | 产生棕黑色沉淀,且放置后不发生变化 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 | 棕黑色沉淀增多,放置后溶液变为紫色,仍有沉淀 |
①浓硫酸 ②饱和食盐水
①;
②在碱性条件下可以被氧化到更高价态。
原因一:可能是通入Cl2导致溶液的碱性减弱。
原因二:可能是氧化剂过量,氧化剂将MnO氧化为MnO
。
①用化学方程式表示可能导致溶液碱性减弱的原因 ,但通过实验测定,溶液的碱性变化很小。
②针对原因二小组同学做如下探究:
| 序号 | Ⅳ | Ⅴ |
| 操作 | 取Ⅲ中放置后的1mL悬浊液,加入4mL40%NaOH溶液 | 取Ⅲ中放置后的1mL悬浊液,加入4mL水 |
| 现象 | 溶液紫色迅速变为绿色,且绿色缓慢加深 | 溶液紫色缓慢加深 |
Ⅳ中溶液紫色迅速变为绿色的离子方程式为 ,溶液绿色缓慢加深,原因是MnO2被 (填“化学式”)氧化,可证明Ⅲ的悬浊液中氧化剂过量。
③分析Ⅳ、Ⅴ实验现象不同的原因是 。