选项 | 物质 | 官能团的名称 |
A |
| 醚键、氨基 |
B |
| 酯基、羧基 |
C |
| 碳溴键、羟基 |
D |
| 碳碳双键、醛基 |
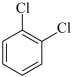 (对二氯苯)
(对二氯苯)
选项 | 实验目的 | 分离或提纯方法 | 原理 |
A | 分离食用油和汽油 | 分液 | 食用油和汽油的密度不同 |
B | 分离溶于水中的溴 | 乙醇萃取 | 溴在乙醇中的溶解度较大 |
C | 除去乙烷中的乙烯 | 通过酸性KMnO4溶液洗气 | 乙烯与酸性KMnO4溶液反应 |
D | 除去碘中的NaCl | 加热、升华 | NaCl的熔点高,碘易升华 |
选项 | 实验操作 | 实验现象 | 实验结论 |
A | 用精密pH试纸分别测定相同浓度NaClO和CH3COONa溶液的pH | pH: | 酸性强弱: |
B | 将相同大小的铜片、铝片用导线连接,平行放入浓硝酸中 | 铜片不断溶解 | 活泼性:Al<Cu |
C | 取5 mL 0.1 mol/L KI溶液于试管中,加入1 mL 0.1 mol/L | 溶液变血红色 | KI与 |
D | 向盛有2 mL、0.1 mol/L NaOH溶液的试管中滴加4~5滴0.1 mol/L | 先生成白色沉淀,后生成蓝色沉淀 | 说明: |
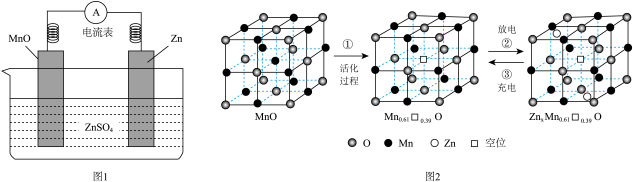
已知:晶体中某结点上的原子空缺了,则称为空位。
 C . 距离A最近且等距离的C有8个
D .
C . 距离A最近且等距离的C有8个
D . 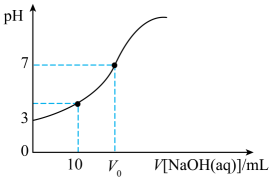

使用现代分析仪器对有机物M的分子结构进行测定,相关结果如下:
①根据图2,M的相对分子质量为。

②根据图3,推测M可能所属的有机化合物类别和其分子式分别为、。

③根据以上结果和图4(两个峰的面积比为2∶3),推测M的结构简式为。M的同分异构体有种,写出两种能与钠反应的结构简式:。

A.![]() B.
B.
C.![]() D.
D.![]()
与
具有相同的电子结构,
小于
, 原因是。

①EDTA中电负性最大的元素是(填元素符号),其中C原子的杂化轨道类型为。
②EDTA分子中不存在的化学键有(填选项字母)。
a.离子键 b.共价键 c.σ键 d.π键 e.配位键

①该铁氮化合物的化学式为。
②一个晶胞内Fe(Ⅱ)构成的一个正八面体的体积为cm。
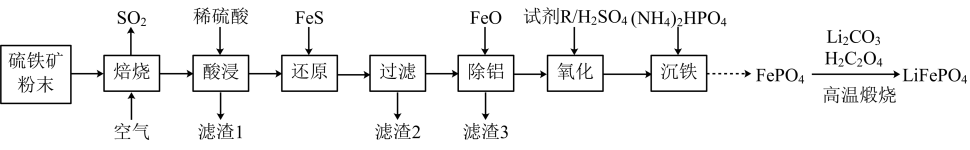

长方体晶胞的长和宽均为apm,高为bpm,NA为阿伏加德罗常数的值,晶体的密度为g•cm-3。
2C(s)+O2(g)=2CO(g) △H2=-221kJ•mol-1
2NO(g)+2CO(g)N2(g)+2CO2(g) △H3=-747kJ•mol-1
碳完全燃烧时的热化学方程式为。

①曲线a、b对应温度较低的是(填“曲线a”或“曲线b”)。
②M点时混合气体的平均相对分子质量为(结果保留两位小数)。
t/min | 0 | 1 | 2 | 3 | 4 | 5 |
p/kPa | 200 | 185 | 173 | 165 | 160 | 160 |
①反应开始到刚达平衡状态的时间段内,v(CO)=kPa·min-1 , 该反应条件下的平衡常数Kp=(kPa)-1(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。该反应中正反应速率v正=k正·p2(NO)·p2(CO),逆反应速率v逆=k逆·p(N2)·p2(CO2),则该温度下,该反应的k正 (填“>”“<”或“=”)k逆。
②能判断反应已达到化学平衡状态的是(填字母序号)。
A.N2和CO2的浓度比保持不变 B.容器中熵值保持不变
C.2v正(NO)=v逆(N2) D.气体的密度保持不变
