 的单体是( )
的单体是( )
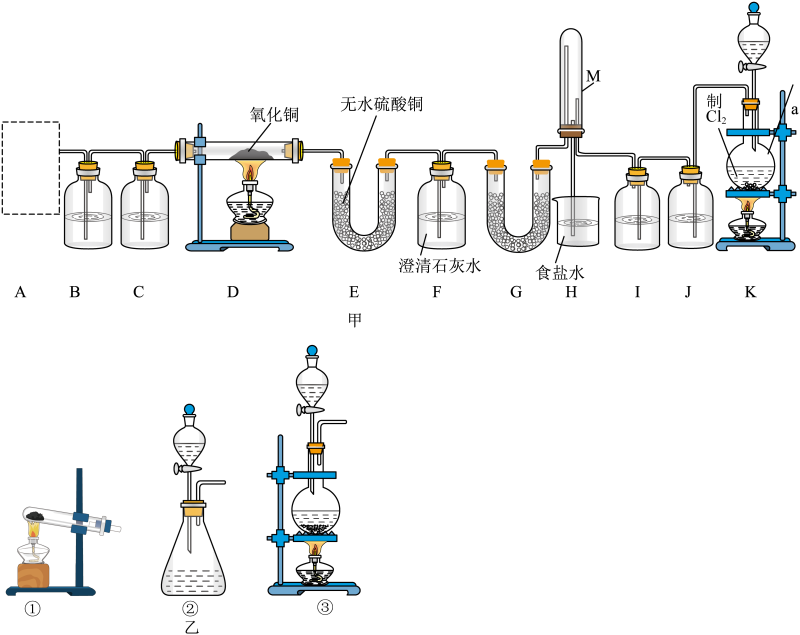
①NaOH(s) ② ③
④
⑤NaCl(aq)

![]()
混合物 | 所用试剂 | 除杂方法 | |
A | 乙烯(二氧化硫) | 氢氧化钠溶液 | 洗气 |
B | 乙醇(乙酸) | 氢氧化钠溶液 | 蒸馏 |
C | 乙烷(乙烯) | 四氯化碳 | 洗气 |
D | 溴苯(溴) | 苯 | 分液 |


反应器中初始反应的生成物有两种,且物质的量之比为1:4,甲烷与水蒸气在一定条件下发生上述反应的化学方程式是 。
①NH3的电子式为 。
②工业合成氨的化学方程式是。
③用如图所示装置实现电化学合成氨。产生NH3的电极反应式是 。

①冷却NO2有利于提高HNO3产率,原因是 (写出一点即可)。
②步骤Ⅴ的化学方程式是 。
时间 | 0 | 1 | 2 | 3 | 4 | 5 |
| 10.0 | 4.50 | 2.50 | 1.50 | 1.00 | 1.00 |
| 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
前2s内的平均反应速率,从表格看,已达化学平衡的时间段为:。

下列叙述正确的是。
a.时,反应未达到平衡,
浓度在减小
b.时,反应达到平衡,反应不再进行
c.各物质浓度不再变化
d.各物质浓度相等
e. ,
浓度增大
f.反应过程中气体的颜色不变
实验编号 | | | |
① | 180 | | 0.1 |
② | | | 5 |
③ | 350 | | 5 |
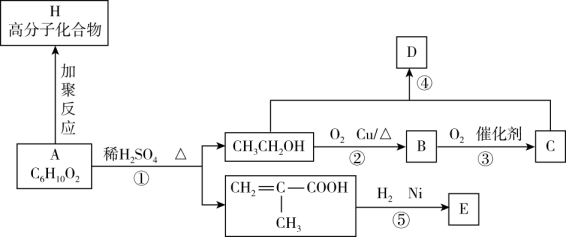
①能发生银镜反应
②分子中含两个甲基
③能和金属钠反应生成氢气