选项 | 操作 | 现象 | 实验结论 |
A | 将乙烯通入溴的四氯化碳溶液 | 溶液最终变为无色且有分层现象 | 生成的1,2-二溴乙烷无色、不溶于四氯化碳 |
B | 向某溶液中加入BaCl₂溶液,有白色沉淀生成,再滴加过量稀盐酸 | 沉淀不溶解 | 该溶液中一定含有SO42- |
C | 将SO₂通入酸性KMnO₄溶液 | 溶液褪色 | SO₂具有还原性 |
D | 向淀粉溶液中加入几滴稀硫酸,煮沸几分钟,向冷却液中加入新制Cu(OH)₂,加热 | 无砖红色沉淀生成 | 淀粉没有水解 |
![]()
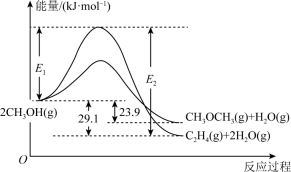
①2CH3OH(g) ⇌ C2H4(g)+2H2O(g) △H1;
2CH3OH(g) ⇌ CH3OCH3(g)+H2O(g) △H2。
下列说法正确的是( )
实验序号 | 温度/℃ | H2SO4溶液体积/mL | Na2S2O3溶液体积/mL | H2O体积/mL | 出现沉淀所需的时间/s |
Ⅰ | 30 | 10 | 5 | 5 | t1 |
Ⅱ | 30 | 5 | 5 | a | t2 |
Ⅲ | 60 | 10 | 5 | 5 | t3 |
已知:①Na2S2O3 + H2SO4 = Na2SO4 + SO2 + S↓+ H2O ②实验结果:t2>t1>t3。
下列说法错误的是( )
|
t/s |
0 |
50 |
150 |
250 |
350 |
|
n(NH3) |
0 |
0.24 |
0.36 |
0.40 |
0.40 |

a.降低温度 b.增大压强 c.恒容时充入He气
d.恒压时充入He气 e.及时分离NH3
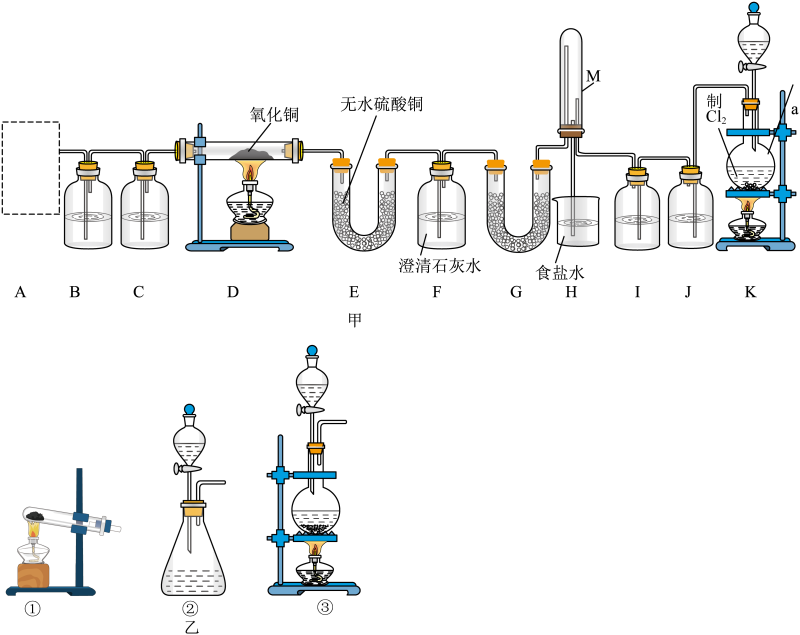
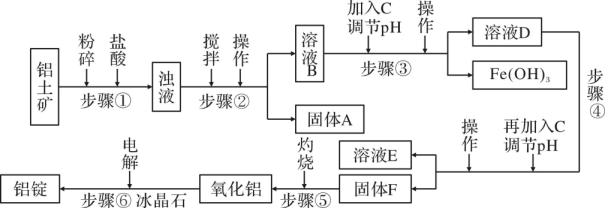
一些难溶物开始沉淀和完全沉淀的 pH 如表所示:
沉淀物 | Al(OH)3 | Fe(OH)3 | Mg(OH)2 |
开始沉淀 pH(离子初始浓度为 0.01mol·L-1) | 4 | 2.3 | 10.4 |
完全沉淀 pH(离子浓度<10-5mol·L-1) | 5.2 | 3.2 | 12.4 |
请回答下列问题:
a.Fe b.氨 c.过量氢氧化钠稀溶液
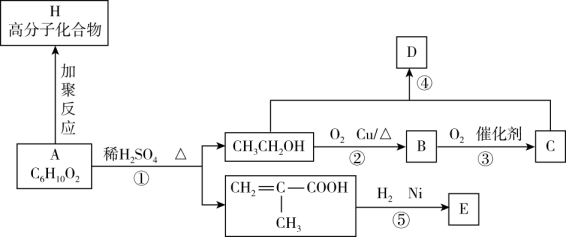
①能发生银镜反应
②分子中含两个甲基
③能和金属钠反应生成氢气