下列叙述错误的是
A | 硫酸亚铁溶液出现棕黄色沉淀 | |
B | 硫化钠溶液出现浑浊颜色变深 | |
C | 溴水颜色逐渐褪去 | |
D | 胆矾表面出现白色粉末 |
|
选项 |
实验操作及现象 |
结论 |
|
|
常温下将铁片分别插入稀硝酸和浓硝酸中,前者产生无色气体,后者无明显现象 |
稀硝酸的氧化性比浓硝酸强 |
|
|
取一定量 |
此样品中含有 |
|
|
将银和 |
|
|
|
向溴水中加入苯,振荡后静置,水层颜色变浅 |
溴与苯发生了加成反应 |
①
②
③
计算反应④的
;
⑤
⑥
以上反应体系中,芳香烃产物苯乙烯、苯和甲苯的选择性S()随乙苯转化率的变化曲线如图所示,其中曲线b代表的产物是,理由是;

苯乙烯聚合有多种方法,其中一种方法的关键步骤是某(Ⅰ)的配合物促进
(引发剂,X表示卤素)生成自由基
, 实现苯乙烯可控聚合。

已知:①金属的化学性质和
相似,
的熔点为
;
②(乙醚)和
(三正辛胺)在上述流程中可作为配体;
③相关物质的沸点:
|
物质 |
|
|
|
|
|
沸点/ |
55.7 |
34.6 |
42.4 |
365.8 |
回答下列问题:


NO2+SO2+H2O=NO+H2SO4
2NO+O2=2NO2
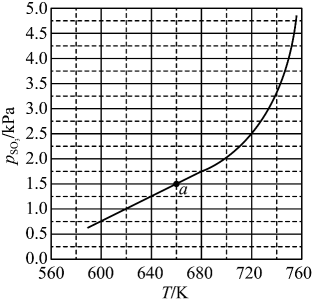
(ⅰ)上述过程中NO2的作用为。
(ⅱ)为了适应化工生产的需求,铅室法最终被接触法所代替,其主要原因是(答出两点即可)。
SO2(g)+O2(g)
SO3(g) ΔH=-98.9kJ·mol-1
(ⅰ)为寻求固定投料比下不同反应阶段的最佳生产温度,绘制相应转化率(α)下反应速率(数值已略去)与温度的关系如下图所示,下列说法正确的是。

a.温度越高,反应速率越大
b.α=0.88的曲线代表平衡转化率
c.α越大,反应速率最大值对应温度越低
d.可根据不同下的最大速率,选择最佳生产温度
(ⅱ)为提高钒催化剂的综合性能,我国科学家对其进行了改良。不同催化剂下,温度和转化率关系如下图所示,催化性能最佳的是(填标号)。

(ⅲ)设O2的平衡分压为p,SO2的平衡转化率为αe , 用含p和αe的代数式表示上述催化氧化反应的Kp=(用平衡分压代替平衡浓度计算)。

a.Si-Cl键极性更大 b.Si的原子半径更大
c.Si-Cl键键能更大 d.Si有更多的价层轨道


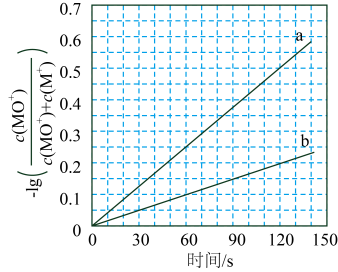
实验②中Cu溶解的离子方程式为;产生的气体为。比较实验①和②,从氧化还原角度说明的作用是。

a.升高温度 b.增大压强 c.加入催化剂
已知:Ksp[Fe(OH)3]=2.8×10-39 , Ksp[Al(OH)3]=1.3×10-33 , Ksp[Ni(OH)2]=5.5×10-16。
回答下列问题:

根据上述实验结果,可知,
。
则的
。

已知:最高价铬酸根在酸性介质中以存在,在碱性介质中以
存在。
回答下列问题:
a.稀硫酸 b.浓硫酸 c.盐酸 d.磷酸
①
②
反应③的
, 平衡常数
(用
表示)。

(ⅰ)步骤Ⅰ和Ⅱ中涉及氢原子成键变化的是(填“Ⅰ”或“Ⅱ”)。
(ⅱ)直接参与化学键变化的元素被替换为更重的同位素时,反应速率会变慢,则与
反应的能量变化应为图中曲线(填“c”或“d”)。
(ⅲ)与
反应,氘代甲醇的产量
(填“>”“<”或“=”)。若
与
反应,生成的氘代甲醇有种。
A.低温低压B.低温高压C.高温低压D.高温高压

①下列说法正确的是。
A.可循环利用,
不可循环利用
B.过程ⅱ,吸收
可促使
氧化
的平衡正移
C.过程ⅱ产生的最终未被
吸收,在过程ⅲ被排出
D.相比于反应Ⅰ,该流程的总反应还原需吸收的能量更多
②过程ⅱ平衡后通入 , 测得一段时间内
物质的量上升,根据过程ⅲ,结合平衡移动原理,解释
物质的量上升的原因。
①常压下和
按物质的量之比
投料,某一时段内
和
的转化率随温度变化如图1,请在图2中画出
间R的变化趋势,并标明
时R值。

②催化剂X可提高R值,另一时段内转化率、R值随温度变化如下表:
|
温度/℃ |
480 |
500 |
520 |
550 |
|
|
7.9 |
11.5 |
20.2 |
34.8 |
|
R |
2.6 |
2.4 |
2.1 |
1.8 |
下列说法错误的是
A.R值提高是由于催化剂X选择性地提高反应Ⅱ的速率
B.温度越低,含氢产物中占比越高
C.温度升高,转化率增加,
转化率降低,R值减小
D.改变催化剂提高转化率,R值不一定增大