
|
|
|
|
图① | 图② | 图③ | 图④ |
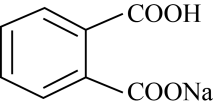 溶液中,
溶液中, 和
和 的离子数目之和为0.01NA
的离子数目之和为0.01NA
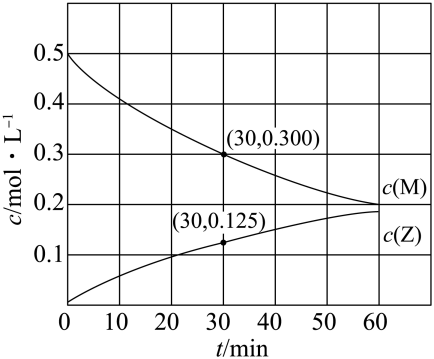

下列说法错误的是
实验1:测得0.1mol·L-1H2SO3溶液pH=2.1。
实验2:向10mL0.1mol·L-1NaHSO3溶液中逐滴加入5mL水,用pH计监测过程中pH变化。
实验3:用0.1mol·L-1NaOH溶液滴定10mL0.1mol·L-1H2SO3溶液。
实验4:向10mL0.1mol·L-1Na2S溶液中加入10mL0.1mol·L-1MnSO4溶液,充分混合,产生粉色沉淀,再加几滴0.1mol·L-1CuSO4溶液,产生黑色沉淀。
下列说法不正确的是( )
选项 | 实验方案 | 现象 | 结论 |
A | 将红热的铁与水蒸气在高温条件下反应,反应结束后,将磁铁靠近产物 | 反应结束后有黑色固体生成,且该固体被磁铁吸引 | 铁与水蒸气在高温下反应,生成 |
B | 为了验证 | 酸性高锰酸钾溶液紫色褪去 | |
C | 取 | 加入稀盐酸前,溶液由黄色变为红棕色。加入稀盐酸和 | |
D | 向少量蒸馏水的试管里滴加2滴 | 溶液变血红色 | |
电离能/( | | | | | …… |
Fe | 759 | 1561 | 2597 | 5290 | …… |
则,铁的第四电离能()大于第三电离能(
)的可能原因是:。

①具有脱氯作用的离子是。
②溶液失去脱氯作用后,补加FeBr2或加入,脱氯作用恢复。
③富集、制取Br2:A吸收了Br2后,Br2歧化为和Br-。则A是(填字母)。
A.NaCl溶液 B.Na2CO3溶液 C. SO2气体
试剂组成 | 1 mol/LNaBr溶液 | 1mol/LNaBr溶液 | 将B中反应后溶液 |
20% H2SO4 | 98% H2SO4 | 用水稀释 | |
实验现象 | 无明显现象 | 溶液呈棕红色放热 | 溶液颜色变得很浅 |
①B中溶液星棕红色说明产生了。
②分析C中溶液颜色变浅的原因,甲同学认为是发生了化学反应所致:乙同学认
为是用水稀释所致。若认为甲同学的分析合理,请用具体的反应说明理由;若认
为乙同学的分析合理,进一步设计实验方案说明。理由或方案:。
③酸化歧化后的溶液宜选用的酸是(填“稀硫酸”或“浓硫酸”)。
反应Ⅰ
反应Ⅱ
反应Ⅲ
①下列有关说法正确的是。
A.因为反应Ⅱ、Ⅲ自发,且为熵减小反应,所以、
B.若随温度的上升而增大,则
C.随温度升高,反应Ⅱ、Ⅲ的化学平衡先正向移动后逆向移动
D.当温度范围:T≤715K时,相同条件下的反应Ⅱ的平衡常数小于反应Ⅲ

②从图2中可看出,当体系温度高于600K时,乙烯的摩尔分数随温度升高而显著增加,可能的原因是:。
①平衡时的转化率为。
②已知810K条件下,存在等式(常数)
(对于气相反应,用某组分B的平衡压强p(B)可代替物质的量浓度c(B),如
, p为平衡总压强,x(B)为平衡系统中B的物质的量分数)。保持其它条件不变,请在图3中画出x(HI)与压强(0.1~2.0MPa)关系的曲线示意图。

Zn2++2Fe2++3C2O+6H2O
ZnFe2(C2O4)3·6H2O↓
ZnFe2(C2O4)3·6H2O……
某兴趣小组按下列流程制备ZnFe2O4。
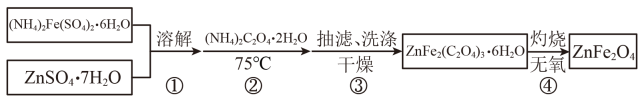
请回答:
a.烧杯 b.坩埚 c.蒸发皿 d.马弗炉 e.表面皿
完成灼烧得到产品的化学方程式是。
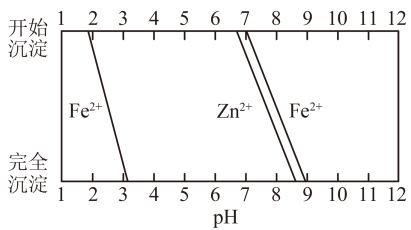
从以下选择合适步骤并填空;d→→→→i→→→e;
a.加入新制氯水;
b.锌皮完全溶于稍过量的3 mol·L-1稀硫酸;
c.加入30%H2O2;
d.锌皮用热碱洗涤干净;
e.过滤、洗涤、干燥;
f.过滤得ZnSO4溶液;
g.加入纯ZnO粉末;
h.蒸发浓缩,冷却结晶;
i.加热到60℃左右,并不断搅拌;
其中步骤i中加热的主要目的是:。
①谱表明:分子中共有3种不同化学环境的氢原子;
②IR谱检测表明:苯环上有多酚羟基且相邻,且分子不含-CN,含-N=O;
③分子中还有一个五元碳环。
