

 C . 硫的化合物中化合价与其氧化性、还原性的关系:
C . 硫的化合物中化合价与其氧化性、还原性的关系:  D . 氨水与SO2反应后溶液中的铵盐:
D . 氨水与SO2反应后溶液中的铵盐: 

对于该溶液表述正确的是( )
 向NaOH溶液中滴加AlCl3溶液至过量
B .
向NaOH溶液中滴加AlCl3溶液至过量
B .  向NaAlO2溶液中滴加盐酸至过量
C .
向NaAlO2溶液中滴加盐酸至过量
C .  向Na2CO3溶液中逐滴加入稀盐酸
D .
向Na2CO3溶液中逐滴加入稀盐酸
D .  向含有Mg2+和Al3+的溶液中加入NaOH溶液至过量
向含有Mg2+和Al3+的溶液中加入NaOH溶液至过量
请计算:
Ⅰ.配制氢氧化钡溶液
|
|
|
|
|
|
A | B | C | D | E | F |

接通电路后,缓慢通入CO2至过量,整个过程中灯泡的亮度变化为,观察到溶液中的现象为。
方案一 | 将装置甲产生的气流通入少量纯水至饱和,测pH值与饱和二氧化碳溶液做对比 |
方案二 | 将装置甲产生的气流通入AgNO3溶液,观察是否有沉淀产生 |
A.只有方案一 B.只有方案二 C.方案一和方案二均可 D.方案一和方案二均不行
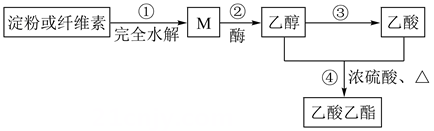
a.淀粉和纤维素的分子式均为(C6H10O5)n , 但n值不同
b.反应③的类型为加成反应
c.M可与银氨溶液在碱性、加热条件下反应析出银
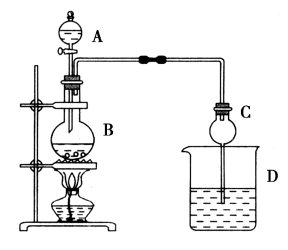
已知:①氯化钙可与乙醇形成微溶于水的;
②;
③有关有机物的沸点如下表:
|
试剂 |
乙醚 |
乙醇 |
乙酸 |
乙酸乙酯 |
|
沸点/℃ |
34.7 |
78.8 |
118 |
77.1 |
加热一段时间,B中生成乙酸乙酯的化学反应方程式为。
a.五氧化二磷 b.碱石灰 c.无水硫酸钠 d.生石灰
①称取n g草酸晶体配成100.00 mL水溶液;
②取25.00 mL所配制的草酸溶液置于锥形瓶中,加稀硫酸,用浓度为a mol·L-1的KMnO4溶液滴定,已知2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
试回答下列问题:
A.托盘天平(带砝码,镊子)
B.滴定管 C.100mL容量瓶
D.烧杯E.漏斗 F.锥形瓶 G.玻璃棒 H.烧瓶
Ⅰ.该实验装置的组合是(填字母)。
a. ①④⑤
B. ①③⑤
C. ②④⑤
D. ③⑤⑥
Ⅱ.所选用装置的连接顺序应是(填各接口的字母,连接胶管省略)。
①向400mL该溶液中通入0.3mol CO2 , 则所得溶液中HCO3–和CO32–的物质的量浓度之比约为。
A.1:3 B.1:2 C.2:1 D.3:1
②将上述溶液蒸发结晶得到Na2CO3和NaHCO3固体混合物,下列选项中不能准确测定混合物中Na2CO3质量分数的是。
a. 取a g混合物充分加热,在干燥器中冷却至室温,减重b g
b. 取a g混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b g固体
c. 取a g混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b g
d. 取a g混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b g固体

溶液 | 加入的物质 | 序号 |
①AlCl3溶液 | 通入过量的NH3 | |
②Na2CO3和NaOH的溶液 | 滴入过量的盐酸 | |
③NaAlO2溶液 | 滴加稀硫酸至过量 |
①写出铁与过量稀硝酸反应的离子方程式。
②写出过量铁与稀硝酸反应的离子方程式。
③若28克铁与含1.6摩尔硝酸的稀硝酸恰好完全反应,则生成的Fe3+和Fe2+的物质的量之比。
④上述反应结束后,向反应后的溶液中加足量氢氧化钠溶液,滤出沉淀洗涤后,在空气中灼烧至质量不变,最终得到的固体质量为g。
①配平方程式: Al+NO3-+OH-=AlO2-+N2↑+。
②上述反应中,还原剂与还原产物的物质的量之比是 ,反应中转移电子0.3mol,标准状况下生成N2是mL。
① ;② ;③ ;
④ ;⑤;⑥ .
①根据以上数据,能否推理计算出标准状况下CO2的体积?若能,用代数式表示CO2的体积V(CO2)= .若不能,理由是 .
②根据以上数据,能否推理计算出NaOH溶液的浓度?若能,用代数式表示NaOH溶液的浓度c(NaOH)= . 若不能,理由是