①氧硫化碳(COS)含有的化学键类型。
A.σ键 B.π键 C.金属键 D.离子键
②C、O、S的电负性大小顺序是(用元素符号表示)。

石墨烯中C原子的轨道杂化方式为,从石墨中剥离得到石墨烯需克服的作用是;在石墨烯中,每个六元环占有个C原子。

I.以氨为原料可生产尿素[化学式为CO(NH2)2],其原理分两步进行:
①2NH3(g)+CO2(g)NH2COONH4(l) ΔH1=-117kJ•mol-1
②NH2COONH4(l)CO(NH2)2(l)+H2O(g) ΔH2=+15kJ•mol-1
上述反应在常温下(填“能”或“不能”)自发进行。

①T1、T2、T3由小到大的顺序为。
②在T2、60MPa条件下,平衡时N2的转化率为%;若此时容器体积为1L,则平衡常数K=(保留两位有效数字)。
Ⅲ.东南大学王金兰课题组提出合成氨的“表面氢化机理”如图,在较低的电压下实现氮气的还原合成氨。
已知:第一步:*+H+e-=*H(快)(吸附在催化剂表面的物种用*表示)
第二步:N2+2*H=中间体(吸附在催化剂表面)(慢)
第三步: (快)


在酸性水溶液中,光催化脱除原理和电化学反应原理类似。g-C3N4端的反应为O2+2H++2e-=H2O2 , P1端的反应为。
无害化处理水体中的含氮化合物(以NH3、NO、NO
等形式存在)也是生态文明建设的重要环节之一。

①Pt电极(a)为极(填“正”或“负”);Pt电极(b)上的电极反应式为。
②电池总反应的化学反应方程式为,反应一段时间后,KOH溶液的浓度将(填“增大”“减小”或“不变”)。
本题中所涉及离子的氢氧化物溶度积常数如表:
离子 | Fe3+ | Zn2+ | Cu2+ | Fe2+ | Mg2+ |
Ksp | 4.0×10-38 | 6.7×10-17 | 2.2×10-20 | 8.0×10-16 | 1.8×10-11 |
回答下列问题:
A.NH3•H2O B.Ca(OH)2 C.NaOH D.MgO
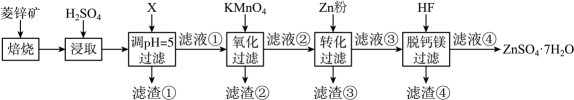
滤渣①的主要成分是。

①请在结构图中用箭头标出配位键。
②该配离子所含配体的分子空间构型为。