
 B . 滴瓶上的滴管使用后直接放回原瓶
B . 滴瓶上的滴管使用后直接放回原瓶 C . 滴加液体
C . 滴加液体
实验 |
|
|
|
|
实验目的 | A.测定空气中氧气的含量 | B.探究纯金属和合金的硬度大小 | C.探究蜡烛中是否含有碳元素 | D.探究固体溶于水后的能量变化 |


选项 | 实验内容 | 实验设计 |
A | 分离CO2和CO | 用NaOH溶液吸收 |
B | 鉴别NaOH和NH4NO3固体 | 分别溶于水,测溶解前后液体温度的变化情况 |
C | 除去NaCl溶液中的Na2CO3 | 滴加过量的氯化钙溶液,过滤 |
D | 验证某溶液中含硫酸根离子 | 加入氯化钡溶液,看是否有白色沉淀 |
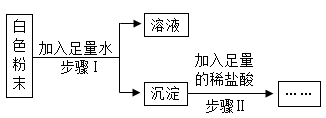
关于该实验的说法正确的是( )

A.产物无污染B.贮存困难
C.燃烧热值高D.制取成本高
①铝制品具有很好的抗腐蚀性能,原因是。
②将一定质量的铝片加入Cu(NO3)2和Mg(NO3)2的混合溶液中,充分反应后过滤,得到滤渣和无色滤液。滤渣中一定含有的金属是;滤液中一定含有的溶质是。
删去两边不参加反应的离子,即得离子方程式:
碳酸钠溶液和稀盐酸反应的微观实质是:。
中国政府努力争取在2060年前实现“碳中和”。“碳中和”就是针对排放的二氧化碳,采取各种方式全部抵消,实现二氧化碳的零排放。实现“碳中和”可以通过森林碳汇和人工手段加以捕集、利用和封存CO2.目前,CO2捕集技术的关键是将CO2从排放物中分离出来。分离方法主要分为物理吸收法和化学吸收法。物理吸收法中的一种是用甲醇作溶剂进行吸收;另一种是用活性炭、沸石等对CO2进行吸附性吸收。化学吸收法中的吸收剂有钙基吸收剂等。用钙基吸收剂时,先将吸收剂热解成CaO。CaO可在较高温度下捕集CO2。CaC2O4·H2O热分解可制备CaO,CaC2O4·H2O加热升温过程中固体的质量变化见图。

已知400~600℃范围内发生的分解反应为:CaC2O4CaCO3+CO↑

【查阅资料】SiO2难溶于水,也不与CO、稀盐酸、稀硫酸反应。

向收集满CO2的软塑料瓶中加入约占1/4体积的水,立即旋紧瓶盖,振荡,观察到软塑料瓶变瘪(如图1)。该实验不能证明CO2与水发生反应,理由是。
按图2所示进行实验,则图3中的曲线(填“A”或“B”)表示氢氧化钠溶液与二氧化碳的反应,该反应的化学方程式为;向二氧化碳中加入80mL蒸馏水的目的是。

实验三:产物转化法实验
完成下列表格:
第一组 | 第二组 | |
步骤1 | 向氢氧化钠溶液中通入二氧化碳 | 向氢氧化钠溶液中通入二氧化碳 |
步骤2 | 向上述溶液中。 | 向上述溶液中滴加足量的稀盐酸 |
实验现象 | 有白色沉淀生成 | 有气泡产生 |
实验结论 | 氢氧化钠溶液与二氧化碳发生了反应 | |
实验反思:第二组向步骤1的溶液中滴加稀盐酸时,起初并无明显现象,滴加稀盐酸一段时间后有气泡产生,可能的原因是。
查阅资料:氢氧化钠易溶于乙醇,碳酸钠微溶于乙醇。
进行实验:如图4所示,取2mL4%的氢氧化钠乙醇溶液于试管中,向试管中吹气约30秒。观察到的实验现象:。
实验结论:氢氧化钠与二氧化碳发生反应。

