 C .
C . 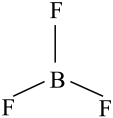 (平面三角形)
D . 基态碳原子的轨道表示式:
(平面三角形)
D . 基态碳原子的轨道表示式:
选项 | 实验事实 | 理论解释 |
A | N原子的第一电离能大于O原子 | N原子2p轨道上的电子处于半充满状态 |
B | 键角: | 电负性:N>P |
C | 酸性: | 甲基是推电子基团 |
D | HF的沸点高于HCl | 键能:H—F>H—Cl |


选项 | A | B | C | D |
实验 目的 | 检验1-溴丙烷消去反应的产物 | 石油的分馏 | 实验室制硝基苯 | 验证酸性:盐酸>碳酸>苯酚 |
实验 装置 |
|
|
|
|
选项 | 实验操作 | 结论 |
A | 向某溶液中滴加 | 原溶液中有 |
B | 2 | |
C | 向浓度均为0.05 | |
D | 对于 | 平衡向生成 |

下列说法错误的是( )

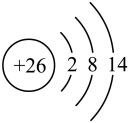
①阴离子的空间构型是。
②配离子中,中心离子的配位数是,N与中心原子形成的化学键是键。
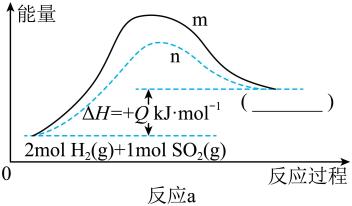
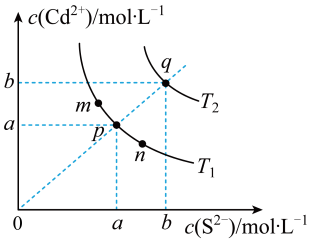
①曲线(填“m”或“n”)表示的是有催化剂参与反应的过程。
②图中括号内应该填写。
向恒温恒容密闭容器中充入一定量的CO和 , 发生反应b。下列描述可判断该反应达到平衡状态的是____。
①0~tmin内,
②该温度下,反应b的平衡常数
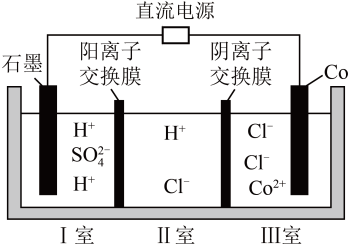
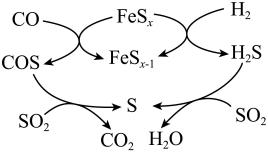
该方法的部分反应过程如图所示。下列说法合理的是____。

请回答下列问题:
①A为氯气发生装置,发生反应的离子方程式是。(高锰酸根离子被还原为)。
②除杂装置B中盛放的试剂是,装置D的作用是。
③C中得到紫色固体和溶液,C中发生的反应有:
, 另外还有。(用化学方程式表示)
①取C中紫色溶液,加入稀硫酸,产生黄绿色气体,得溶液a,经检验气体中含有。为证明是否是
氧化了
而产生
, 设计以下方案:
方案I | 取少量溶液a,滴加KSCN溶液至过量,溶液呈红色。 |
方案II | 用KOH溶液充分洗涤C中所得固体,再用KOH溶液将 |
I.由方案I中溶液变红可知溶液a中含有离子。
II.方案II可证明氧化了
。用KOH溶液洗涤的目的是排除(填离子符号)的干扰。
②根据的制备实验可判定,氧化性:
(填“>”或“<”);而方案II实验表明,
和
的氧化性强弱关系与上述判定相反,原因是。
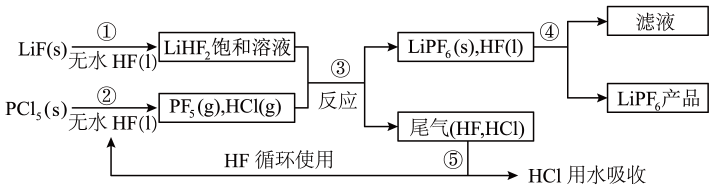
已知:HCl的沸点是−85.0℃,HF的沸点是19.5℃。
请回答下列问题: