 一种原子结构
B .
一种原子结构
B .  镁元素Mg
D . U=IR
镁元素Mg
D . U=IR
①2H②2NH3③SO2④⑤Mg2+⑥2OH﹣⑦H2O




 B . 实验室加热高锰酸钾制取氧气
B . 实验室加热高锰酸钾制取氧气  C . 将水通电分解一段时间
C . 将水通电分解一段时间  D . 用等质量、等浓度的双氧水分别制取氧气
D . 用等质量、等浓度的双氧水分别制取氧气 


| 物质 | 甲 | 乙 | 丙 | 丁 |
| 反应前物质/g | 20 | m | 20 | 20 |
| 反应后物质/g | 2 | 待测 | 32 | 26 |
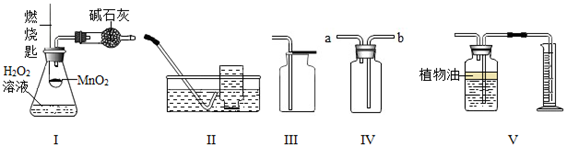
 硫在氧气中燃烧﹣﹣集气瓶中的水:吸收放出的热量
B .
硫在氧气中燃烧﹣﹣集气瓶中的水:吸收放出的热量
B .  测定空气中氧气含量﹣﹣量筒中的水:通过水体积变化得到氧气体积
C .
测定空气中氧气含量﹣﹣量筒中的水:通过水体积变化得到氧气体积
C .  细铁丝在氧气中燃烧﹣﹣集气瓶中的水:防止集气瓶炸裂
D .
细铁丝在氧气中燃烧﹣﹣集气瓶中的水:防止集气瓶炸裂
D .  探究燃烧的条件﹣﹣烧杯中的水:加热铜片:隔绝空气
探究燃烧的条件﹣﹣烧杯中的水:加热铜片:隔绝空气

2个铁原子;m个碳酸根离子;5个二氧化碳分子;硫酸亚铁:;氧化钙中钙元素显+2价:。
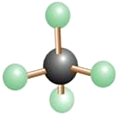

①当x=10+y时,该粒子为(填“原子”或“阳离子”或“阴离子”)。
②若该结构示意图表示的粒子是Cl﹣ , 则y=。


猜想一:生成的气体可能是氧气。
猜想二:生成的气体可能是氢气。
为验证生成的气体是什么,该组同学在老师的指导下,设计了如图所示的实验装置(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。试管A内装有铁粉,烧瓶B中装有一定量的水



实验操作步骤如下:
步骤1:检查装置气密性,且装置气密性良好。
步骤2:将盛有足量白磷的燃烧匙放入空集气瓶中,塞紧塞子,白磷不燃烧。
步骤3:打开集气瓶塞子,往瓶中倒满80℃的热水,并塞紧塞子
步骤4:打开K1和K2 , 通过注射器从b管抽水,当瓶中液面刚低于燃烧匙底部时,立即同时关闭K1、K2 , 发现瓶中白磷燃烧,此时读出注射器中水量为V1毫升,导管b中水的体积忽略不计。
步骤5:待整个装置冷却至室温时,只打开K2 , 发现注射器中的水剩余V2毫升。
某研究小组对烧熟的菜中亚硫酸盐含量做了测试,数据如下表:盖有保鲜膜的菜肴在4℃的冰箱中放置不同时间的亚硝酸盐含量(单位:mg/kg)
| 菜肴 | 半小时 | 6小时 | 18小时 | 24小时 |
| 炒青菜 | 0.6861 | 0.7982 | 4.3333 | 5.3624 |
| 韭菜炒蛋 | 1.8153 | 1.9249 | 2.8390 | 5.6306 |
| 红烧肉 | 2.4956 | 4.2558 | 4.0668 | 5.5188 |
| 红烧鲫鱼 | / | 2.0948 | 3.2300 | 7.2397 |
将一份红烧鲫鱼样本(不盖保鲜膜)在常温下放置4小时,测定其亚硝酸盐含量为8.9483mg/g。
请根据以上材料,回答下列问题:
|
第一次 |
第二次 |
第三次 |
|
|
硫粉的质量/g |
16 |
32 |
32 |
|
铁粉的质量/g |
28 |
28 |
56 |
|
硫化亚铁(FeS)的质量/g |
44 |
44 |
88 |
