 B . 醛基的电子式:
B . 醛基的电子式: D . 聚丙烯的链节:
D . 聚丙烯的链节: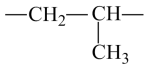
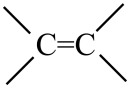
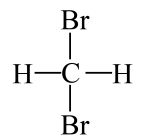 和
和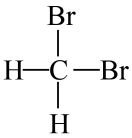 互为同分异构体
D . 乙烷分子中最多有4个原子共平面
互为同分异构体
D . 乙烷分子中最多有4个原子共平面
|
选项 |
实验步骤 |
实验用品 |
|
A |
步骤1:将海带灼烧灰化 |
|
|
B |
步骤2:将海带灰溶解、过滤 |
|
|
C |
步骤3:氧化滤液中的I— |
|
|
D |
步骤4:检验碘单质 |
|
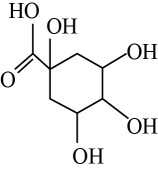
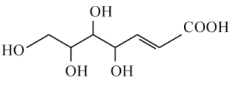 互为同分异构体
D .
互为同分异构体
D . 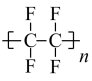 )。下列关于四氯乙烯和聚四氟乙烯的说法正确的是( )
)。下列关于四氯乙烯和聚四氟乙烯的说法正确的是( )
|
选项 |
A |
B |
C |
D |
|
实验设计 |
|
|
|
|
|
实验目的 |
比较HCl、H2CO3和H2SiO4的酸性强弱 |
检验浓硫酸与铜反应后的混合物中是否含有Cu2+ |
制取乙酸乙酯 |
验证淀粉在酸性条件下的水解产物 |
 B .
B . 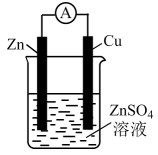 C .
C . 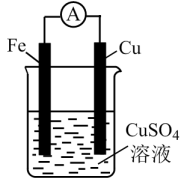 D .
D . 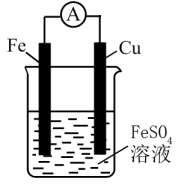
①加H2O
②加KNO3固体
③滴入几滴浓盐酸
④加入少量铁粉
⑤加NaCl溶液
⑥滴入几滴硫酸铜溶液
⑦升高温度(不考虑盐酸挥发)
⑧改用10mL 0.1mol/L盐酸.
|
试管 |
A |
B |
C |
|
所加试剂 |
酸性KMnO4溶液 |
Na2S溶液 |
双氧水 |
|
现象 |
紫红色溶液褪色 |
产生淡黄色沉淀 |
无明显现象 |
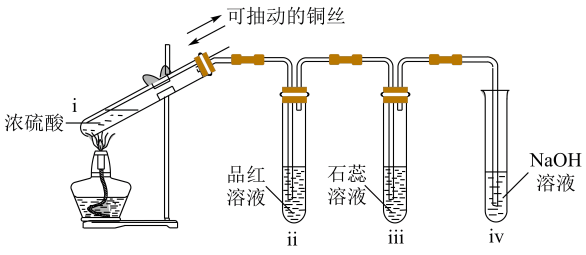
①A中发生反应的离子方程式为;B中反应所得氧化产物与还原产物的物质的量之比为。
②甲同学为证明Na2SO3和H2O2能够反应,进行如下操作:取1mLC中溶液于试管中,先滴加足量(填化学式,下同)溶液,再滴加少量溶液,产生白色沉淀,说明有生成,故甲同学认为二者发生了反应:乙同学认为甲同学的实验方案有缺陷,你认为该缺陷可能为。
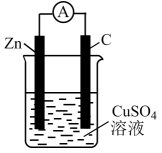
Ⅱ.化学能转化为电能
原电池是将化学能转化为电能的装置,其构成要素可用图1来表示:

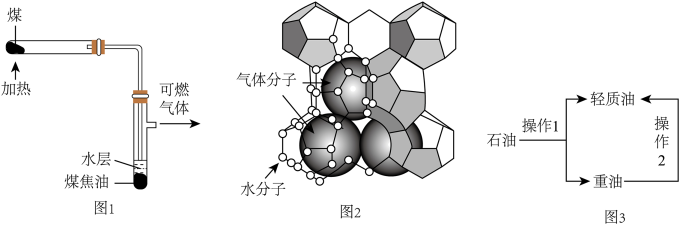

①乙烯的电子式为;聚乙烯的化学式为;A中官能团的名称为。
②反应i的化学方程式为;反应ii的反应类型为。
③制备环氧乙烷主要有两种途径:
途径1:![]()
途径2:![]()
途径2与途径1相比,其优势在于,这一优势充分体现了“绿色化学”思想。
④乳酸可与铁反应制备一种药物,化学方程式为:
其中X的化学式为。
反应原理:____
实验步骤如下表:
|
编号 |
温度℃ |
加入0.1mol/LNa2S2O3溶液的体积/mL |
加入水的体积/mL |
加入0.1mol/LH2SO4溶液的体积/mL |
出现浑浊的时间/s |
|
1 |
25 |
2 |
0 |
2 |
t1 |
|
2 |
25 |
1 |
a |
2 |
t2 |
|
3 |
45 |
2 |
0 |
2 |
t3 |

|
时间/min |
1 |
3 |
6 |
9 |
12 |
|
n(CH3OH)/mol |
0.10 |
0.50 |
0.70 |
0.75 |
0.75 |
反应最快的时间段为(填选项字母):解释其原因为。
A.0~1min B.1~3min C.3~6min D.6~9min
I.自然界中氮的循环(如图所示)

![]()
①过程I:加NaOH溶液,调节pH至9后,升温至30℃,通入空气将氨赶出并回收。加入NaOH溶液时,所发生反应的离子方程式为。
②过程II:在微生物作用下实现的转化,称为硝化过程。在碱性条件下,
被氧气氧化为
的总反应的离子方程式为。

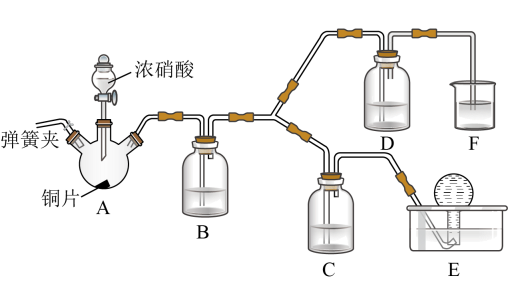
已知:NaOH溶液不与NO反应,能与NO2反应。
①浓硝酸应保存在棕色试剂瓶中,用化学方程式解释其原因为。
②装置A中发生反应的化学方程式为;装置B的作用为。
③装置D中的现象为;C中盛放的试剂为。