①教育目标 ②教育内容 ③教学基本要求 ④教学评价
 B . 稀释浓硫酸
B . 稀释浓硫酸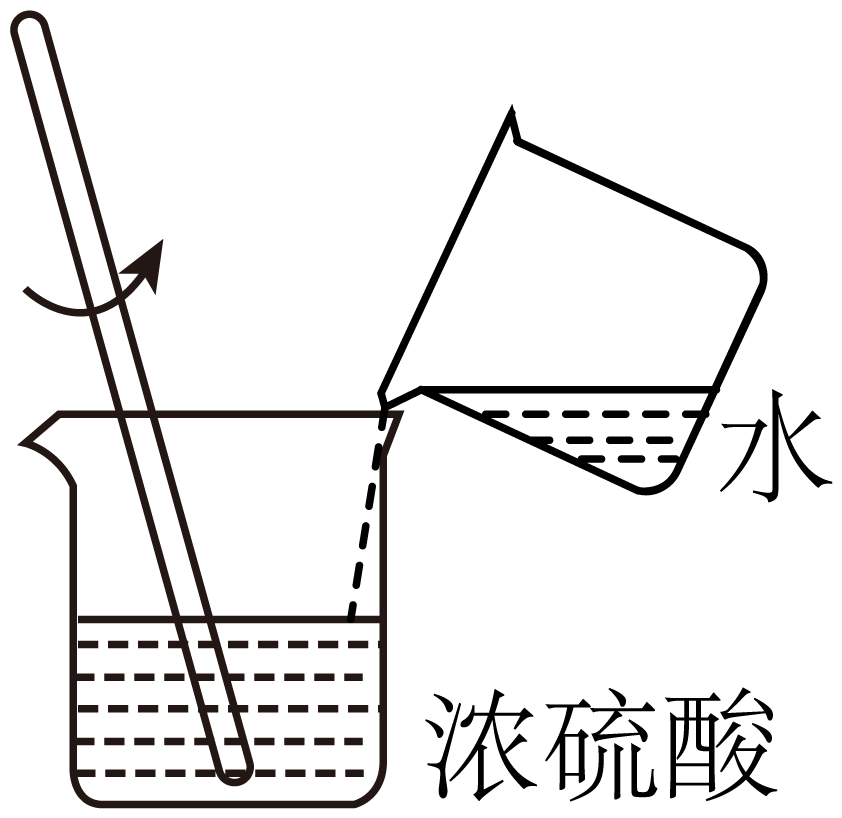 C . 制取氢气
C . 制取氢气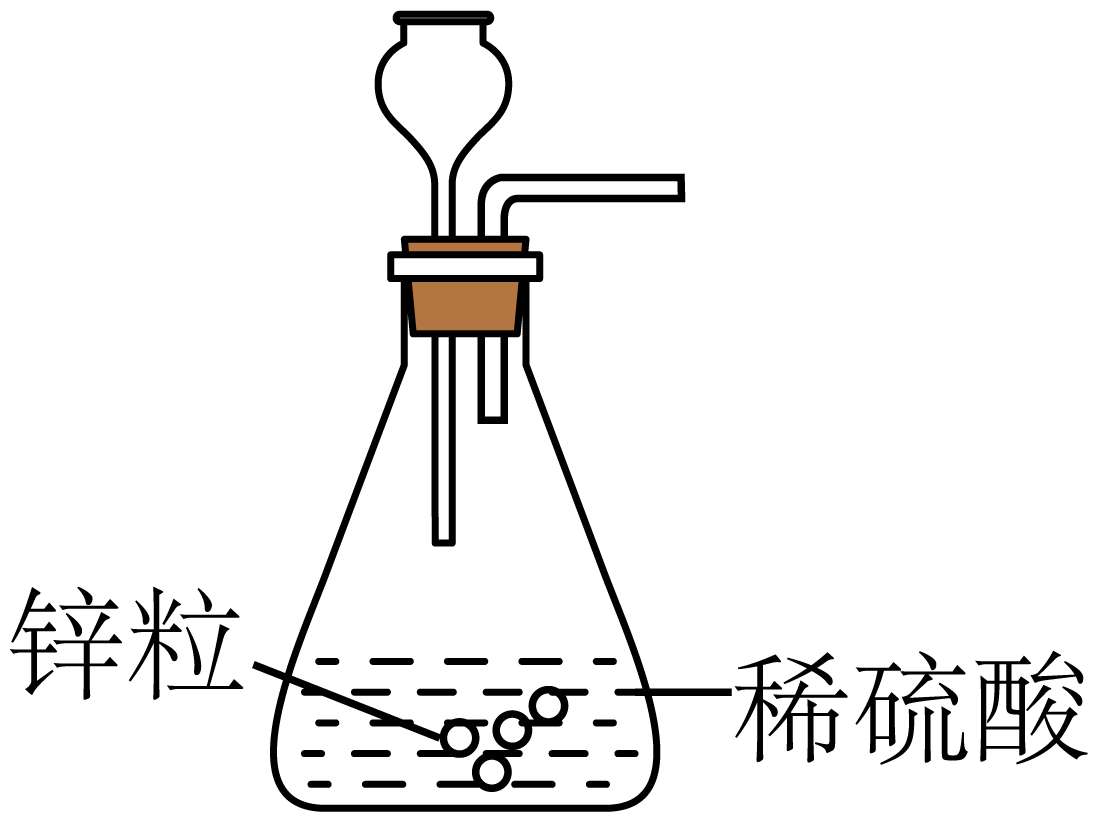 D . 干燥氢气
D . 干燥氢气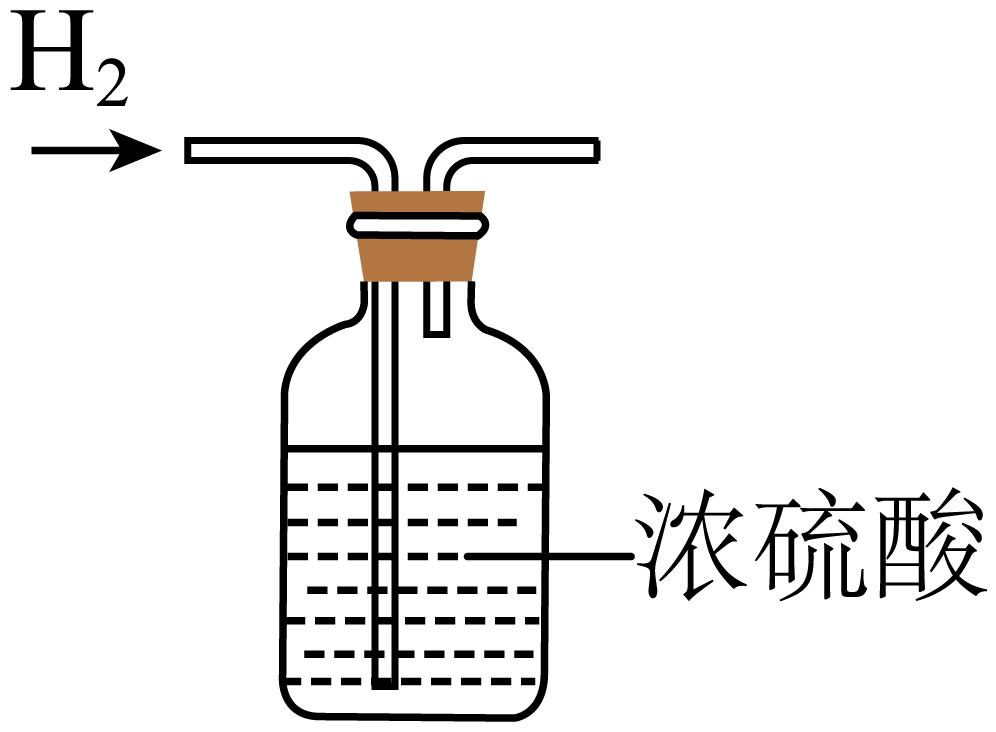


选项 | 实验月的 | 实验方案 |
A | 鉴别硬水和软水 | 取适量水样于试管中,滴加肥皂水后振荡,观察 |
B | 配制50g质量分数为3%的NaCl溶液 | 取1.5gNaCl固体于烧杯中,加入50.0mL水,搅拌 |
C | 鉴别化肥 | 取样,加入熟石灰混合研磨,闻气味 |
D | 证明可燃物燃烧需要达到着火点 | 向盛有80℃热水的两只烧杯中各放入一小块白磷,然后用导管对准其中一块白磷通过 |





①合成尿素的反应为 ,
的化学式是。
②合成碳酸氢铵的反应为 , 该反应需在较(填“高”或“低”)温度下进行。

①加入铁粉的目的是(用化学方程式表示)。过程中还会产生一种气体,其化学式为。
②过滤所得金属的成分是(填化学式)。
①加入溶液后,废水的
(填“增大”“不变”或“减小”)。
②碱式碳酸铜有多种组成,可表示为 ,
和
需满足的关系式为。
③若反应温度过高,会生成一种黑色固体。该固体可能是(填化学式)。

①生石灰与水反应的产物是(填化学式)。
②加入石灰石调节废水的 , 溶液的
始终小于7,原因是。
③每吨生石灰的价格约为460元,每吨石灰石的价格约为130元。联合使用生石灰和石灰石,将这两种物质先后加入废水,调节废水的
至约为7,经济效益较好的可行方案为。
实验Ⅰ.取纯碱样品,加水溶解得溶液 , 测得溶液
约为12。
实验Ⅱ.取溶液X,滴加过量试剂 , 产生能使澄清石灰水变浑浊的气体。
实验Ⅲ.向实验Ⅱ后所得溶液中滴加硝酸银溶液,有白色沉淀生成。
结论:样品中含有氯化钠。
①测定溶液的操作:用玻璃棒蘸取溶液滴在
试纸上,与相比较。
②实验Ⅱ中所加的试剂Y应选用(填字母)。
a.稀盐酸 b.稀硝酸 c.氢氧化钠溶液 d.氯化钙溶液
③由上述实验推断,溶液中含有的阴离子除
外,还有(填离子符号)。
准确称取干燥纯碱样品,加水溶解,逐滴加入溶质质量分数为3.65%的稀盐酸,边滴加边搅拌,当两者恰好完全反应时(含碳物质全部转化为
),消耗盐酸体积为
。(该盐酸的密度近似等于
, 杂质不与盐酸反应)
①通过计算判断该纯碱样品的等级。
无水碳酸钠等级规定如下:
|
|
优等品 |
一等品 |
合格品 |
|
碳酸钠质 |
≥99.2% |
≥98.8% |
≥98.0% |
②实验发现,当滴入盐酸体积略少于时,溶液
就降至7以下(约为5),溶液
小于7的原因是。将此时的溶液者沸,
会略有升高,其原因是。
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 |
| 溶解度/g | 1.54 | 1.33 | 1.17 | 1.01 | 0.85 | 0.72 |
i.
ii.……
写出ii的化学方程式:。

①为使、
除尽,必须保持溶液中
。
②若调节溶液的偏低、将会导致
、
沉淀不完全,其原因是。[已知
,
,
]。

①该工艺中设计萃取、反萃取的目的是。
②萃取率随
升高先增大后减小的可能原因是。
①点剩余固体产物为。(写出计算过程)
②钴的一种氧化物的晶胞(构成晶体的最小结构单元)如题47图-3所示,在该晶体中与一个钴原子等距离且最近的钴原子有个。
