B . 获取纯净水
B . 获取纯净水  C . 获取氯化钠晶体
C . 获取氯化钠晶体  D . 配制10%的食盐水
D . 配制10%的食盐水 

温度(℃) | 0 | 20 | 40 | 60 | 80 |
溶解度(g) | 13.3 | 31.6 | 63.9 | 110 | 169 |




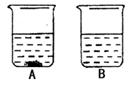


实验一:按下列实验步骤和要求回答粗盐提纯的有关问题。
第一步:溶解。①称量:称量前先把天平调平,准确称取6.0g粗盐。
②量取10mL水倒入烧杯,加粗盐于水中,用玻璃棒搅拌,直到粗盐不再溶解为止。
第二步:过滤。①待过滤的混合液在引流之前先静置一会儿再过滤。
②引流时与玻璃棒下端接触的部分是三层滤纸处。
第三步:蒸发。①如果蒸发皿中有液滴飞溅,原因是。
②当蒸发皿出现时,应停止加热。
第四步:转移。此粗盐精制过程中,玻璃棒在过滤时的作用是。
实验二:用粗盐提纯后得到的精盐(氯化钠)配制了氯化钠溶液,经检测溶质质量分数偏小,其原因可能有(填字母序号,多选)。
①氯化钠固体仍然不纯②称量时砝码和氯化钠放错盘③称量时只在天平左盘垫上滤纸④用量筒量取水时俯视读数⑤配制好的氯化钠溶液装瓶时,有少量溶液洒出

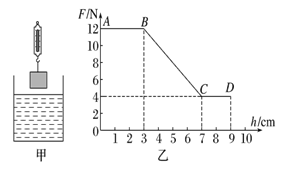
A.记录弹簧测力计的示数为F,这就是大气对吸盘的压力。
B.将蘸水的塑料挂衣钩的吸盘放在光滑玻璃板上,用力挤压吸盘。
C.用弹簧测力计钩着挂钩缓慢向上拉,直到吸盘脱离玻璃板面。
D.量出吸盘与玻璃板接触面的直径,计算出吸盘与玻璃板的接触面积为S。
E.计算出大气压的大小p。


 B .
B .  C .
C .  D .
D . 
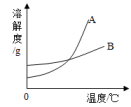
Ⅰ.(实验目的)探究溶解过程中,溶液温度的变化情况。
Ⅱ.(查阅资料)
①物质溶解于水的过程包括吸收热量(Q吸)过程和放出热量(Q放)的过程。
②通常状况下,水的凝固点为0℃、沸点为100℃。
Ⅲ.(提出猜想)物质溶解过程中,溶液的温度可能升高或降低或不变。
Ⅳ.(实验探究)某探究小组的同学设计了如图所示的两种实验方案。图2所示的实验方案中,每次加入物质b之前,均使用温度计控制热水温度,使之保持在99.5℃。

图1实验中,发现玻璃片与烧杯底部之间的水结冰,则溶液温度(填“升高”或“降低”或“不变”)。
Ⅵ.(拓展实验)按照图3所示进行实验。若物质c为氢氧化钠固体,则U型管内的左边液面将(填“高于”或“低于”或“等于”)右边液面。
| 温度/℃ | 0 | 20 | 40 | 60 | 80 | 100 | |
| 溶解度/g | 氯化钠 | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
| 氯化铵 | 29.4 | 37.2 | 45.8 | 55.2 | 65.6 | 77.3 | |

浓硫酸(H2SO4)500毫升 | |
浓度(质量分数) | 98% |
密度 | 1.84克/厘米3 |
相对分子质量 | 98 |
强腐蚀性,阴冷,密封贮藏 | |

求: