 B .
B .  C .
C . 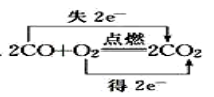 D .
D . 


①XY段溶液的导电能力不断减弱,说明生成的BaSO4不是电解质
②YZ段溶液的导电能力不断增大,主要是由于过量的Ba(OH)2电离出的离子导电
③Y处溶液的导电能力约为0,说明溶液中几乎没有自由移动的离子
④a时刻Ba(OH)2溶液与稀硫酸恰好完全中和

①酸性氧化物在一定条件下均能与碱发生反应
②金属氧化物不一定都是碱性氧化物,但碱性氧化物一定都是金属氧化物
③蔗糖和水分别属于非电解质和电解质
④硫酸、纯碱、醋酸钠和生石灰分别属于酸、碱、盐和氧化物
⑤因为胶粒比溶液中溶质粒子大,所以胶体可以用过滤的方法把胶粒分离出来
⑥氢氧化铁胶体稳定存在的主要原因是胶粒直径介于1nm到100nm之间
⑨:。
⑩:。
①氨水与硫酸溶液混合:;
②Ca(HCO3)2与少量KOH溶液混合:;
③NaOH溶液和NaHSO4溶液混合:.
①.取少量原溶液滴入紫色石蕊试液,溶液呈蓝色。
②.取少许原溶液滴入溶液,无白色沉淀产生。
③.取少许原溶液先滴加硝酸再加溶液,产生白色沉淀。
④.再取少许原溶液滴入少量溶液,有白色沉淀产生。
①加入足量BaCl2溶液,过滤后得到5克白色沉淀:
②在沉淀中加入过量稀硝酸,仍有3克白色沉淀;
③在滤液中滴加AgNO3溶液,产生白色沉淀。
实验①得到的白色沉淀为,则该溶液中一定含有。
①写出该反应的化学方程式:。
②该反应中被氧化的I原子与被还原的I原子的个数之比为。
③每生成2个KIO3 , 该反应中转移电子个。
Na2SO3+ KIO3+ H2SO4 = Na2SO4+ K2SO4+ I2+H2O。
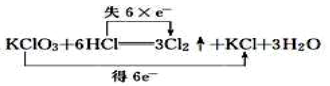
2KClO3+4HCl(浓)=2KCl+2ClO2↑+Cl2↑+2H2O。
①请分析该反应中电子转移的情况(用双线桥表示)。
②浓盐酸在反应中显示出来的性质是 。
③ClO2具有很强的氧化性,因此常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的倍。(提示:ClO2与Cl2消毒时氯元素都被还原为最低价)
①NaCl ②FeCl3 ③K2SO4 ④Na3PO4
甲:将FeCl3饱和溶液滴加到冷水中;
乙:将FeCl3饱和溶液滴加到NaOH溶液中;
丙:将FeCl3饱和溶液滴加到沸水中,继续加热煮沸得到红褐色透明液体。
①丙中反应的化学方程式为。
②向经过检验后的丙中逐滴加入稀盐酸,出现的现象为
③向丙中插入电极后通电,Fe(OH)3胶粒移向(填“与电源负极相连”或“与电源正极相连”)的一极。
④可用如图所示的装置除去Fe(OH)3胶体中的杂质离子来提纯Fe(OH)3胶体,实验过程中需不断更换烧杯中的蒸馏水。该方法名称为。
