B . 泡沫饭盒
B . 泡沫饭盒  C . 易拉罐
C . 易拉罐  D . 垃圾袋
D . 垃圾袋 
![]()
 B .
B .  C .
C . 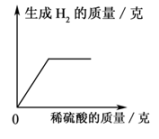 D .
D . 
 B .
B . 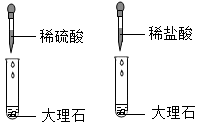 C .
C . 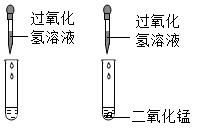 D .
D . 
选项 | 物质 | 杂质 | 方案 |
A | Cu粉 | Zn粉 | 加入足量CuCl2溶液后过滤、洗涤、干燥 |
B | CO气体 | CO2气体 | 通过足量的氢氧化钠溶液后干燥 |
C | NaCl固体 | Na2CO3固体 | 加入足量的稀硫酸后蒸发 |
D | BaCO3固体 | BaCl2固体 | 加水溶解后过滤 |
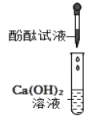 溶液呈红色
B .
溶液呈红色
B .  有白色沉淀生成
C .
有白色沉淀生成
C . 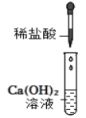 无明显变化
D .
无明显变化
D .  有蓝色沉淀
有蓝色沉淀
 B .
B .  C .
C . 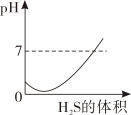 D .
D . 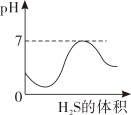
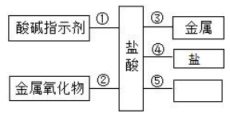
⑴将这包固体粉末加入水中,充分搅拌,过滤,得白色沉淀,上层清液为无色。
⑵向⑴所得的白色沉淀加入盐酸,沉淀部分溶解,放出的无色气体能使澄清石灰水变浑浊。根据上述实验判断,该粉末中一定含有,一定不含有,可能含有
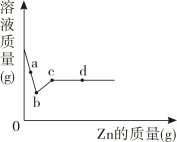
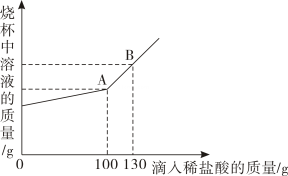
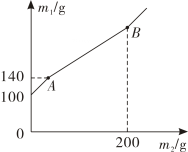
a点溶液中的溶质有。取d点的固体,加入稀盐酸,可观察到的实验现象是。

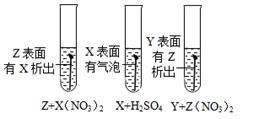
根据实验现象判断,固体样品中含有的物质是。
NaCl+H2O+NH3+CO2=NaHCO3↓+X;2NaHCO3Na2CO3+H2O+CO2↑等。
回答下列问题:
①X的化学式为。
②将碳酸钠和碳酸氢钠的混合物10g充分加热至质量不再改变,冷却,称量剩余固体质量为6.9g,则原混合物中碳酸钠和碳酸氢钠的质量比为。

资料一:过氧化钠与二氧化碳和水都能发生反应,且都放出热量。化学方程式分别为:2Na2O2+2CO2=2Na2CO3+O2↑
2Na2O2+2H2O=4NaOH+O2↑
资料二:氢氧化钙的溶解度随着温度的升高而降低。

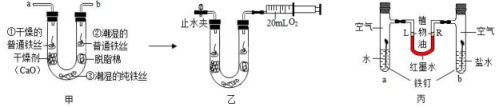
步骤1:利用图甲所示装置,将干燥的氧气从导管a通入U形管(装置气密性良好,药品如图所示);待U形管内充满氧气后,在导管b处连接一活塞推至底部的注射器,收集20mL氧气后在导管a处连接乳胶管并用止水夹夹紧,如图乙所示。
步骤2:一段时间后,观察U形管内的铁丝,其现象如下表所示:
观察对象 | ①干燥的普通铁丝 | ②潮湿的普通铁丝 | ③潮湿的纯铁丝 |
现象 | 没有明显变化 | 较多红褐色锈斑 | 没有明显 |

当滴入几滴酚酞试液后,溶液由无色变为,根据上述实验中颜色变化,可确定稀盐酸与氢氧化钠溶液发生了化学变化。
实验方案 | 实验步骤 | 实验现象 | 实验结论 |
方案一 | 取样,滴入适量的硝酸银溶液 | 出现白色沉淀 | 稀盐酸过量 |
方案二 | 取样,滴入适量的碳酸钠溶液 | ▲ | 稀盐酸过量 |
①请对实验方案一的结论进行评价。
②表格空白处的实验现象是:。

气造成污染。在不借助其它试剂和仪器的情况下,除去废液中对空气造成污染的物质,建议最好先在废液中加入下面(填选项序号)试剂____。

查阅资料可知洁厕灵的有效成分是HCl,HCl的含量可利用NaHCO3溶液来测定,反应的化学方程式为HCl+NaHCO3═NaCl+H2O+CO2↑。洁厕灵其他成分均不参加反应。
向一锥形瓶中加入100克该品牌洁厕灵,再逐次加入一定质量分数的NaHCO3溶液,测出每次锥形瓶中充分反应后溶液的总质量,数据记录如表:
第一次 | 第二次 | 第三次 | |
加入NaHCO3溶液的质量/克 | 100 | 100 | 100 |
反应后溶液的总质量/克 | 197.8 | 295.6 | 395.6 |
实验次数 | 第1次 | 第2次 | 第3次 | 第4次 |
所取样品的质量/g | 50.0 | 50.0 | 50.0 | 50.0 |
加入稀硫酸的质量/g | 20.0 | 40.0 | 60.0 | 80.0 |
生成气体的质量/g | 0.2 | 0.4 | 0.5 | 0.5 |
试回答下列问题:

①恰好完全反应时,消耗Na2CO3的溶质质量为g。
②请通过计算确定Ba(OH)2溶液的溶质质量分数。