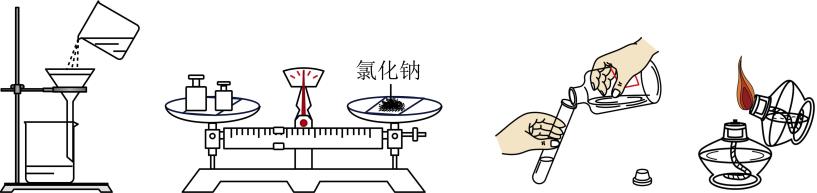
![]()
|
|
|
|
A.加热一定质量的高锰酸钾固体 | B.加热一定量氯酸钾和二氧化锰的固体混合物 | C.木炭在盛有氧气的密闭容器内燃烧 | D.电解水生成两种气体 |
选项 | 实验目的 | 实验方法 |
A | 除去二氧化锰中的氯化钾 | 加水溶解,过滤,洗涤,干燥 |
B | 检验二氧化碳和氮气 | 用燃着的木条 |
C | 鉴别木炭粉和四氧化三铁粉末 | 看颜色 |
D | 鉴别水和过氧化氢溶液 |
若实验中测得氧气的体积分数低于理论值,则造成此误差的可能原因有哪些?。(填一种可能)
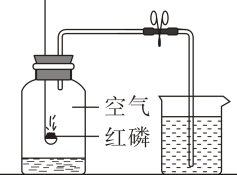
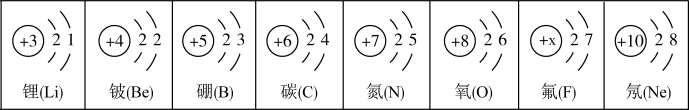
图1
①表中氟原子的质子数x为。
②在化学反应中,原子序数为8的元素的原子容易(填“得”或“失”)电子,一个一氧化碳(CO)分子中的电子数是。
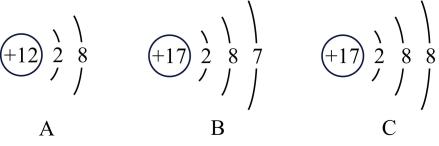
图2
图一  图二
图二
A.③ B.①②③④ C.①② D.①②③
①农业和园林浇灌改漫灌为喷灌、滴灌 ②工业废水直接排入江河中
③生活污水集中处理和排放 ④为提高农作物产量,大量使用化肥、农药


①往盛有5mL5%的H2O2溶液的试管中伸入带火星的木条,无明显现象;
②往盛有5mL5%的H2O2溶液的试管中加入ag Fe2O3固体粉末,伸入带火星的木条,木条复燃;反应停止后,继续向剩余固体粉末中加入5mL5%的H2O2溶液,伸入带火星的木条,木条复燃;重复该步骤实验,带火星木条都复燃,由此(“能”或“不能”)得出Fe2O3是H2O2分解的催化剂,理由是。
③该同学又对催化剂种类和溶液浓度等实验条件进行探究,在等量的不同浓度的H2O2溶液中分别加入等量的MnO2和Fe2O3 , 测定收集等体积氧气所需要的时间,数据如下:
催化剂种类/时间(min)/浓度 | 30% H2O2溶液 | 15%H2O2溶液 | 5% H2O2溶液 |
加入ag MnO2 | 0.2min | 0.8min | 2.0min |
加入ag Fe2O3 | 7.0min | 9.0min | 16.0min |
【实验结论】从表格中能得出哪些结论?(写出一点即可)。
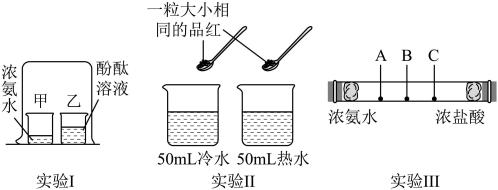
探究一:分子运动速率与温度的关系
实验II中,观察品红扩散速度可得出:温度越高,分子运动越(填“快”或“慢”)。
【猜想假设】猜想1:分子质量越小,分子运动越快;猜想2:分子质量越,分子运动越慢。
【查阅资料】①浓盐酸会挥发出氯化氢(HCl)气体,浓氨水会挥发出氨气(NH3),两种气体反应会产生白烟,即生成白色固体氯化铵(NH4Cl);②氯化氢(HCl)分子质量大于氨气(NH3)分子质量。
【设计实验】
步骤 | 现象 | 结论 |
组装实验III装置,在玻璃管左右两端分别放置沾有浓氨水和浓盐酸的棉花,观察现象。 | 玻璃管(填“A”、“B”或“C”)处先看到白烟 | 猜想1正确 |
【反思交流】
①实验III中,发生反应的文字表达式为;这个反应的基本类型是。
②实验1中,另一烧杯内液体不变红色,是因为(填“酚酞”或“氨气”)的分子质量很大。
③从研究分子性质角度,实验III较实验I的优点是(填序号,2分)。
A.可证明分子间有间隔 B.可证明分子的质量和体积都很小
C.节约药品,操作简单 D.可证明分子运动与温度有关