
|
|
|
|
A.研磨 | B.溶解 | C.过滤 | D.检验 |


已知:I.3为两性氢氧化物;
II.常温下,各物质的溶度积常数如表所示。
化合物 | Cr(OH)3 | Ca(OH)2 | Mg(OH)2 |
Ksp近似值 | 1×10-31 | 5.5×10-6 | 1.8×10-11 |
实验1:在甲中加入足量KI,再滴几滴淀粉溶液,用标准溶液滴定至终点,消耗
2S2O3溶液V1mL。
实验2:在乙中滴几滴2
4;溶液作指示剂,用
3溶液测定氯离子的量,滴定至终点,消耗AgNO3溶液V2mL。
已知:实验1中滴定反应为2
2S2O3
2
。
①若实验Ⅰ中溶液酸性较强,可能会使标准液变质,导致V1偏大,该过程用离子方程式表示:
②若时,可判断产品中全部是FeCl3。
①-1
②C(石墨,s)+O2(g)=CO2(g) △H2=-395kJ•mol-1
③2
2
2
3
-1
已知:标准摩尔生成焓是指在25℃和101kPa时,由元素最稳定的单质生成1mol纯化合物的焓变,如上述反应②可表示为CO2的标准摩尔生成焓。请写出表示乙烷标准摩尔生成焓的热化学方程式。

①由图可知,压强p3(填“>”或“<”)p1 , 原因是。压强为2时,升高温度,反应的平衡常数将(填“增大”、“减小”或“不变”)。
②温度为1100℃、压强为p1时,x点的平衡常数。为(K是指用平衡时各组分的物质的量百分数代替物质的量浓度计算得到的平衡常数)。
③在一定温度、的初始条件下,该反应达到平衡后体系的压强变为100kPa,则CO的平衡转化率为。
④下列说法能说明该反应在上述条件下达到平衡状态的是(填字母)。
A.体系的密度不再发生变化
B.断裂2molH-H键的同时生成2molC=O键
C.各组分的物质的量浓度不再改变
D.体系的气体的平均相对分子质量不再发生变化
E.体积分数:V%(CH4)=V%(CO2)

①已知GaCl3的熔点为77.9℃,LiCl的熔点为605℃,两者熔点差异较大的原因为。
②GaCl3在270℃左右以二聚物存在,该二聚物的每个原子都满足8电子稳定结构,写出它的结构式:。
③-的立体构型为。
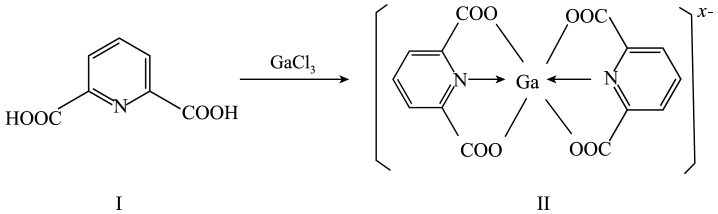
①化合物I中环上N原子的杂化方式为,1mol化合物Ⅰ中含有的σ键的物质的量为。化合物I中所含元素的电负性由大到小的顺序为(用元素符号表示)。
②化合物Ⅱ中Ga的配位数为,x=。

①上述晶胞沿着a轴的投影图为(填选项字母)。
A. B.
B. C.
C.
②用NA表示阿伏加德罗常数的值,晶胞参数为a=b=0.3nm,c=0.386nm,晶胞棱边夹角均为90°,则该晶体密度为g·cm-3(列出计算式即可)。
①分子中除苯环不含其他的环
②苯环上有6个取代基且有一个为-N=N-CH3
 的合成路线(无机试剂和溶剂任选)。
的合成路线(无机试剂和溶剂任选)。